Research progress of blood-brain barrier crossing strategies and brain-targeted drug delivery mediated by nano-delivery system
-
摘要:
血脑屏障(blood-brain barrier,BBB)是存在于脑组织与血浆之间的半通透性生物屏障,然而其物理特性、酶特性、免疫特性及独特的转运机制严重限制了治疗药物和诊断试剂入脑,为脑部疾病防治带来了巨大挑战。基于此,本文首先总结并分析了BBB复杂的结构组分和多样的转运机制,探讨了跨越BBB药物递送的难点及可行途径;进而,介绍并讨论了各类纳米递送系统在跨越BBB实现脑内药物递送的最新研究进展及未来发展趋势,为进一步完善其设计和推动其转化提供了参考;最后,就常见脑部疾病中BBB的病理变化探讨了如何针对病理BBB设计相应的药物递送策略。本文强调了基于纳米递送系统的跨越BBB药物递送策略的设计与优化,并为目前脑内药物递送所面临的机遇和挑战提供了解决思路。
Abstract:The blood-brain barrier (BBB) is a semi-permeable biological barrier between brain tissue and plasma, however, its physical, enzymatic and immune properties, as well as its unique transport mechanism severely limit the entry of therapeutic drugs and diagnostic agents into the brain, which poses great challenges for the prevention and treatment of brain diseases. Hence, this review summarizes and discusses the complex structural components and various transport mechanisms of BBB, and interprets the difficulties and feasible ways of drug delivery across BBB. Furthermore, the latest research progress and future development trends of various delivery systems for brain drug delivery are introduced and discussed to provide references for further perfecting their design and driving their transformation. Finally, this review discusses the pathological changes of BBB in brain diseases and the design of drug delivery strategies for pathological BBB. Collectively, this review highlights the design and optimization of drug delivery strategies across the BBB based on nano-delivery system and provides accessible guide for current opportunities and challenges of intracerebral drug delivery.
-
目前计算机辅助药物设计(computer-aided drug design, CADD)与传统药物设计方法结合[1],已逐渐成为药物设计的主流方法,弥补了高通量筛选(high-throughput screening,HTS)[2]的缺陷。然而,传统的计算机辅助药物设计方法无法有效穿透庞大的药物化学空间(约1060量级)。因此,生成新颖、独特且有效的分子仍然是一项挑战性的任务[3]。近年来,随着人工智能技术的蓬勃发展,将分子生成模型引入药物发现过程已成为分子设计、合成的研究热点,为药物设计和开发打开了新的视角和途径。当前常用的生成模型包括生成对抗网络(GAN)、变分自编码器(VAE)和扩散模型(diffusion model)等[4]。本文对近5年药物设计工作中的小分子生成模型进行介绍,并根据不同药物设计场景对其进行归纳,并展望小分子生成模型在药物设计场景的发展方向及挑战。
1. 分子生成模型概念
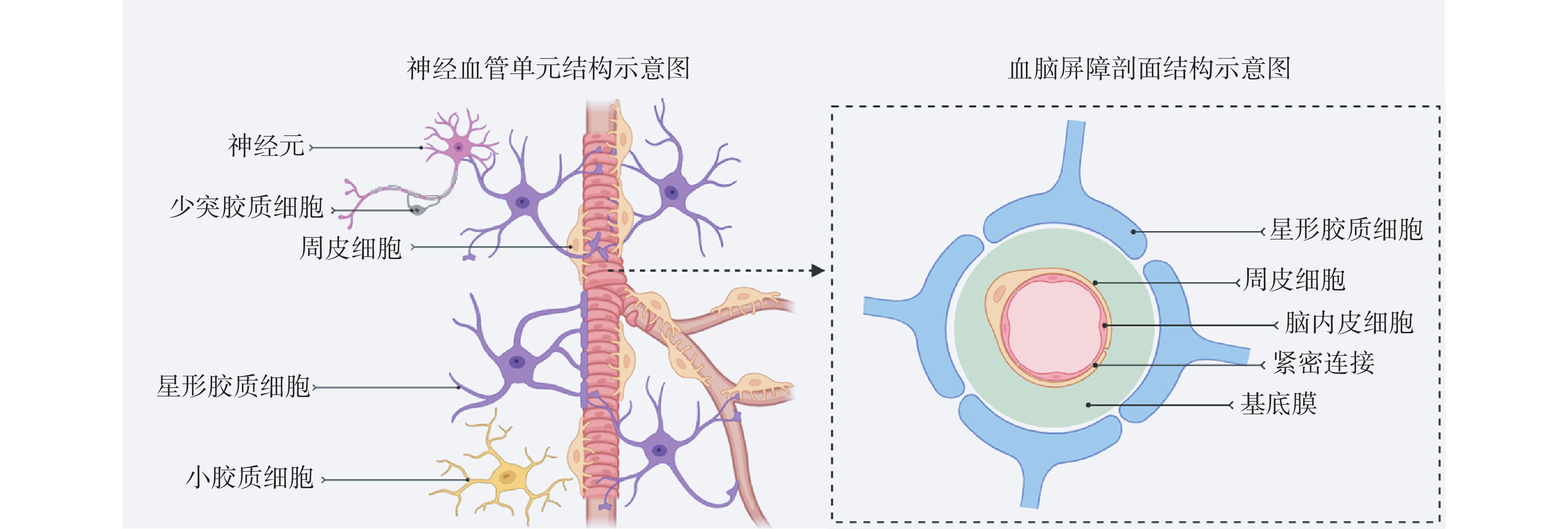
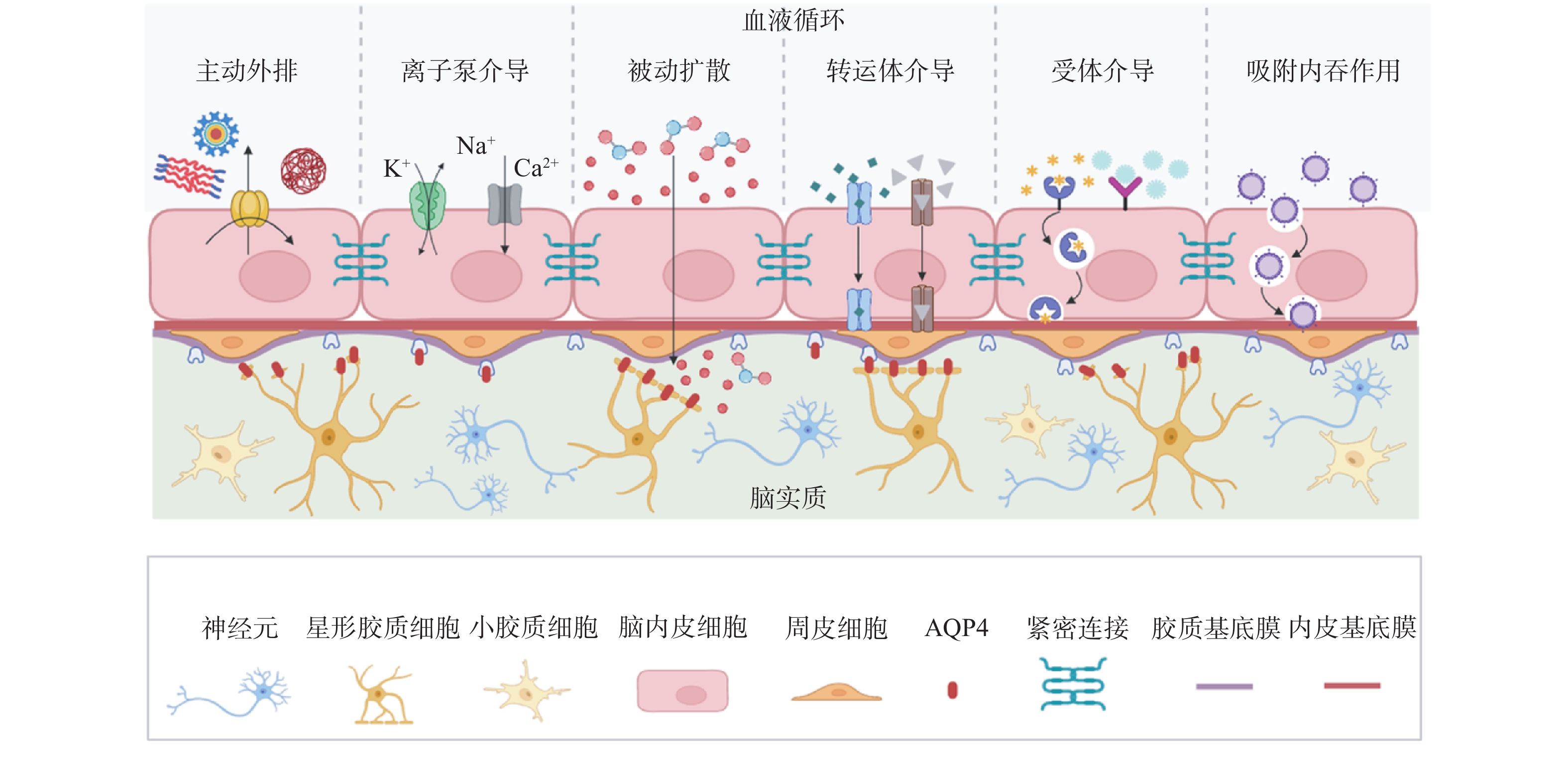
1.1 分子生成模型结构
现有的分子生成方法分为基于配体的分子生成(ligand-based molecular generation, LBMG)和基于结构的分子生成(structure-based molecular generation, SBMG)(图1-A和1-B)[5]。其中,基于配体的分子生成方法主要根据现有活性分子骨架及其属性来生成分子。然而,由于LBMG方法是在缺少靶点口袋信息的情况下进行训练和生成,其无法考虑分子与靶蛋白的相互作用,且可能会因训练集中的活性分子骨架多样性不足而产生偏差。因此,该方法生成的分子将有可能缺乏多样性,不利于突破专利壁垒。而基于结构的分子生成方法是近年来药物设计领域的一个重要发展方向,该方法利用靶蛋白的三维结构信息,如靶蛋白的活性位点或口袋等关键区域的详细结构信息,来引导新分子的生成和优化。与基于配体的方法相比,基于结构的方法能够更直接地考虑分子与靶蛋白的相互作用,从而更精准地设计出类药分子。
1.2 数据来源和特征
1.2.1 数据来源
高质量的数据在分子生成领域发挥着至关重要的作用。在这一过程中,数据库(database)和数据集(dataset)是关键的组成部分。如图1-C所示,在分子生成研究中,常用的小分子数据库包括ZINC数据库、ChEMBL数据库以及基准数据集如MOSES数据集和QM9数据集等。这些数据集分别提供了不同类型的分子数据,以支持化学规则、药物化学过滤和3D构象生成模型的研究。此外,一些带有靶标信息的数据库和数据集主要为基于靶蛋白口袋的分子生成提供帮助,包括提供序列信息的Uniprot数据库,提供蛋白质-配体复合物数据的CrossDock数据集和PDBbind数据库。RCSB PDB和AlphaFold蛋白质结构数据库则为分子生成提供了大量的实验解析和人工智能预测的靶标结构数据。
1.2.2 数据特征
在分子和蛋白质的表示法方面,一维、二维和三维方法各展其优,并针对不同的应用场景具有独特的应用价值和优势[6]。对于一维表示法,其广泛应用于小分子和蛋白质的表示中。小分子通过SMILES格式进行表示,这种方法利用ASCII字符串以直观和简洁的方式描述化学结构(图1-D) [6]。蛋白质的一维表示通常依赖于氨基酸序列,以反映其组成和序列顺序(图1-E)[7]。在二维表示法中,分子结构通过图表示法进行分析,其中分子被视为图,原子和化学键分别作为节点和边(图1-D)[8]。尽管这种方法在形式上是二维的,它却能够编码三维信息,例如通过将原子坐标和键角编入节点和边的属性中(图1-E)[9]。三维表示法是从物理模型到计算技术的重大变革。3D分子图是一种常见的三维表示方式,直接将原子的三维坐标作为三维特征,而3D分子网格则通过体素(体积元素,volume pixel)的方式来表示分子构象中的不同元素或属性(图1-D)。而通常,三维表征的坐标会利用等变图神经网络,如E(n)或SE(n)模型进行处理,这保持了输入数据的几何不变性和对称性,使得它们在蛋白质结构预测、功能分析和药物设计等方面展现出了高效率和准确性(图1-E)[10]。
2. 主流分子生成模型算法
2.1 变分自编码器
变分自编码器(variational autoencoders,VAE)包含两个核心组件:编码器与解码器(图2-A)。在VAE的训练过程中,关键是最小化包含重构损失与正则化项的损失函数。重构损失确保解码器根据隐变量准确重建原始分子,而正则化项则利用Kullback-Leibler(KL)散度衡量重构分子的分布与原始数据分布之间的偏差。这种方法有效地确保了模型能够生成既高质量又在统计上与真实分子匹配的分子[11]。
2.2 生成对抗网络
生成对抗网络(generative adversarial network,GAN)构建了一个由两个相互竞争的网络组成的系统:一个是负责生成新的分子结构的生成器(generator),另一个是专注于区分合成分子结构与真实分子结构的判别器(discriminator)(图2-B)[12]。这一竞争机制不仅促进了模型生成逼真分子的能力,也提高了模型在学习和理解复杂分子特征方面的效率[13]。
2.3 扩散模型
扩散模型(diffusion models)的设计灵感来源于物理学中的非平衡热力学原理,它们通过定义一个马尔科夫链的扩散步骤,涵盖了正向扩散过程和逆向扩散过程两个阶段(图2-C)[14]。在正向扩散过程中,这些模型会逐步向数据注入随机噪声,直到数据逐渐演变成各向同性的高斯分布状态;而在逆向扩散过程中,则执行相反的操作,从噪声状态重构出原始的数据样本。这种方法使扩散模型在生成真实样本方面展现出显著的能力[15]。
2.4 标准化流模型
标准化流(normalizing flow)通过实施一连串的可逆变换,实现了从简单的先验分布(比如高斯分布)到复杂高维数据(例如分子结构)的高效桥接。与变分自编码器(VAE)相比,其能够进行精确的数据似然计算,显著提升了新分子结构的生成能力,并在化学及药物设计领域中对生产高品质分子展现出巨大潜力(图2-D)[16]。
2.5 递归神经网络模型
递归神经网络(RNN)是一类用于处理序列数据的神经网络,通过其独特的反馈连接结构,能够在序列的每个步骤中传递先前的信息,从而有效捕捉时间序列或序列数据中的动态特性(图2-E)。RNN在处理序列化的分子表示(如SMILES字符串)方面显示出独特的优势,使其在生成具有特定化学性质的分子方面具有更高的灵活性和准确性[17]。
2.6 Transformer模型
Transformer模型(自注意力模型)自2017年提出以来,已经彻底改变了自然语言处理(NLP)等序列处理任务的面貌(图2-F)。近年来,Transformer的应用领域不断扩展,分子生成领域也开始尝试利用其强大的序列建模能力。此外,Transformer的并行处理能力显著提高了模型的训练和推理速度,这对于处理大规模分子数据集尤为重要[18]。
3. 分子生成模型的评价基准
在分子生成模型的研究领域,评价指标对于衡量模型性能和指导模型改进至关重要。这些评价指标主要分为两大类:药物样性和多元化评价指标。药物样性指标评估分子成药潜质,如物理化学属性(如相对分子质量、脂水分配系数)等[19]。Bickerton等[20]提出的药物样性的定量估算(QED)是一种基于批准药物分子属性的评估方法,涵盖了分子质量、疏水性和极性等。Weng等[21]开发的RediscMol基准用于评估生成模型在生物属性方面的表现,为药物设计提供指导。Handa等[22]探讨了分子生成模型实际验证的挑战,通过案例研究发现,公共数据上模型的表现优于专有数据,指出评估新化合物设计方法在药物发现中的难度。Ertl等[23]提出的SAscore基于片段贡献和复杂性惩罚,与药物化学家估计的合成可能性显示出良好一致性。Thakkar等[24]开发的RAscore,一个基于机器学习的快速合成可行性估计方法,至少比传统方法快4500倍,适用于早期药物发现阶段。Wang等[25]的DeepSA使用深度学习预测化合物合成可达性,性能优于现有方法,特别是在区分难合成分子方面。除了传统和合成可行性评价指标,新兴的评价方法如空间得分(SPS)[26−28]等。
4. 小分子生成模型在药物发现中的应用与进展
4.1 分子从头生成
分子从头生成(de novo molecular generation)是一种旨在自动提出新化学结构的方法,常用于药物发现以获取具有理想的生物效应和药代动力学特性的分子。近期研究进展包括Guo等[29]通过结合课程学习(CL)与基于REINVENT的方法,提升了从头分子设计的质量,显示出CL在加速学习和提高生成质量方面的优势。Zhang等[30]提出的ResGen模型,利用并行多尺度建模原则,通过分层的自回归过程直接在蛋白质口袋内生成3D分子,有效捕捉分子与口袋间的相互作用,提高了计算效率和生成的物理合理性。此外,该团队还以“锁钥”原理的方式开发了包含两个等变神经网络(Geodesic-GNN和Geoattn-GNN)的SurfGen模型,其通过结合拓扑和几何结构学习,分别捕获口袋表面的拓扑相互作用和配体原子与表面节点之间的空间相互作用[31]。Mokaya等[32]探索了基于SMILES字符串的分子生成极限,通过课程学习和深度强化学习,提出了循环迭代优化程序(rIOP)来优化分子生成,允许更好地控制生成分子集的组成。Moret等[33]利用化学语言模型(CLM)结合结构和活性信息,生成了具有中到低纳摩尔级别活性的PI3Kγ抑制剂,验证了其在脑癌细胞模型中对PI3K/Akt通路的有效抑制作用。Qian等[34]开发的KGDiff模型,将化学知识引导融入扩散模型中,通过知识指导的去噪过程,有效提高了结合亲和力。Xu等[35]开发了Tree-Invent模型,通过强化学习和拓扑树约束,灵活地探索目标化学空间,除了从头生成外,还可以应用于骨架跃迁等。
4.2 基于片段修饰的分子生成
4.2.1 基于骨架
在现代药物发现领域,骨架修饰和骨架跃迁是关键技术,用于创造具有新颖生物活性的分子。Lim等[36]的研究展示了如何使用VAE作为图生成模型来进行基于骨架的分子设计,该方法能够顺序地添加原子和键,生成衍生分子,在保留主骨架结构的同时控制分子属性。Hu等[37]开发了基于Transformer的分子生成模型SyntaLinker-Hybrid,通过片段杂交化和迁移学习步骤以及对BRAF激酶的对接实验验证了其有效性。Zheng等[38]提出的DeepHop模型,基于结合分子3D构象和蛋白质序列信息的多模式Transformer架构,专注于骨架跃迁,生成具有高生物活性的新型骨架分子,展示了优异的性能。Fialková等[39]开发的基于强化学习的生成模型LibINVENT,通过指定化学反应快速创建共享相同核心的化合物库。Loeffler等[40]报道的REINVENT 4,基于自注意力机制的变换器架构,设计用于生成小分子的开源框架。Liao等[41]开发的Sc2Mol模型采用VAE生成骨架,以及使用Transformer进行结构修饰的两步流程,展示了其在学习化学规则和优化类药物分子设计方面的能力。Liu等[42]的DrugEx v3模型,通过多目标强化学习,侧重于生成类似药物的配体,引入了新位置编码方案以在一个骨架中生长多个片段。Xu等[43]报道的3D-SMG模型,结合了交叉聚合连续滤波卷积(ca-cfconv)实现高效的空间特征提取,并引入了用于ADMET特性预测的数据自适应多模型方法,取得了优异的性能。Hu等[44]提出的ScaffoldGVAE,通过变分自动编码器原理和多视图神经网络,实现药物分子的骨架生成和跃迁,侧重于保留分子侧链同时修饰骨架。Xie等[45]基于扩散模型开发的DiffDec,通过骨架修饰优化分子,结合三维口袋约束,提高结构感知R-Group的生成。
4.2.2 基于片段
基于片段的药物设计(fragment-based drug design, FBDD),通过3种主要策略:片段生长、片段连接、片段合并,将片段分子优化为先导化合物。Bilsland等[46]提出了一个基于长短期记忆(LSTM)网络的“双重”自动编码器,能同时重构SMILES和分子指纹。这种模型通过对分子指纹解码器层应用迁移学习,生成了一个分类器模型,识别预测为频繁命中的新片段。Hadfield等[47]开发STRIFE模型,从靶蛋白结构提取片段热点图(FHMs),引导片段生长,且允许用户指定设计的片段结构并生成拓展物。Du等[48]的3D-MCTS模型利用蒙特卡洛树搜索(MCTS)算法,通过多线程并行模拟和实时能量约束的剪枝策略,高效识别具有优化目标结合亲和力的分子。Powers等[49]的FRAME模型,基于SE(3)-等变神经网络,用于片段生长,展现出在预测配体亲和力和选择性方面的显著优势。Sauer等[50]提出了一种基于演员-评论家模型(actor-critic model)的片段强化学习变体,引入冷冻片段(freezing fragments)和使用试剂作为片段源,结合基于化学反应的拆分方案,提高了可合成性,调整网络输出概率以平衡新颖性和多样性。Wang等[51]的Frag-G/M框架,基于条件Transformer、递归神经网络(RNN)和强化学习,减少了模型训练中标签数据的使用,生成的分子展示了良好的骨架多样性。
此外,在生成片段化合物库方面,目前也取得良好的进展,如Eguida等[52]报道的POEM方法,利用所有公开的蛋白质-配体复合物结构信息,生成针对特定目标的化合物库,该模型已成功应用于生成150万个潜在的CDK8抑制剂库。Buehler等[53]通过分析公共数据库中的分子,探索了生物活性片段空间的扩展,通过生成数据库GDB-13s,发现了许多新的、结构简单且具有合成可及性的片段。Diao等[54]的MacFrag模型,通过改进的BRICS规则和高效的子图提取算法,快速枚举分子片段空间,为大规模数据库的片段化提供了一种高效方法。
4.2.3 基于连接子
基于片段的药物发现已经成为早期药物开发的一个有效范式。其中,在靶向蛋白降解嵌合体(PROTAC)或抗体偶联药物(ADC)的设计中,连接子(linker)的选择和设计至关重要。Imrie等[55]提出了DeLinker,一个基于图的深度生成模型,结合三维结构信息应用于片段连接、骨架跃迁和PROTAC设计等场景。Yang等[56]开发的SyntaLinker,一个基于约束的Transformer架构,通过编解码层处理分子片段序列,自动连接片段并生成完整分子,验证了其在片段连接、骨架跃迁等方面的应用。Tan等[57]提出了DRlinker,基于强化学习,控制药物设计中片段的连接,生成具有特定属性(如Linker长度和log P)的化合物,展示了其在骨架跃迁场景中的潜力。Li等[58]开发的PROTAC-INVENT,一个三维生成模型,专为PROTAC Linker设计,通过强化学习生成二维结构及与靶蛋白和E3连接酶的三维结合构象(PTS),且包含对PROTAC的对接协议。Kao等[59]提出的AIMLinker,基于变分自编码器,专门为PROTAC Linker设计,通过整合输入片段的结构信息来优化先导化合物,内置过滤机制确保生成具有优良化学属性的分子。Zhang等[60]的GRELinker,结合基于图的神经网络(GGNN)、强化学习和课程学习(CL)算法,提高了生成满足多重属性约束条件分子的比例,CL策略使其能生成更复杂的Linker结构。
4.3 基于药效团
药效团,作为药物分子中与靶蛋白相互作用的关键部分,包括氢键给体或受体、疏水区域和电荷区域等,能够精确捕获配体与靶蛋白之间的相互作用。Imrie等[61]提出了一种基于图的生成模型DEVELOP (DEep Vision-Enhanced Lead OPtimisation),该模型结合了图神经网络(GNN)和卷积神经网络(CNNs),将3D药效团信息约束纳入分子生成过程。Zhu等[62]则提出了以药效团引导的分子生成模型(pharmacophore-guided molecule generation, PGMG)。该模型利用药效团作为药物-靶标相互作用所必需的空间分布化学特征,通过不需要特定活性数据进行训练来克服数据稀缺的限制。
4.4 基于组学
组学(Omics)是一种全面表征和定量分析生物体内分子群体的方法,它深入探究了生物分子层面的结构、功能和动态变化 [63]。Born等[64]提出了基于强化学习和靶细胞或癌症部位的转录组特征的分子生成框架PaccMannRL。该方法利用变分自编码器来定制针对特定转录组轮廓的分子,使用抗癌药物敏感性预测模型作为奖励函数,从而优化分子生成过程。Pravalphruekul等[65]提出了一个基于变分自编码器的生成模型BiCEV,旨在从差异基因表达数据中设计具有多重作用潜力的新分子,并通过提供基因敲除图谱来验证 BiCEV,并评估生成的分子与已确认的沉默基因抑制剂的相似程度。此外,Das等[66]基于变分自编码器提出了Gex2SGen,其以非细胞特异性方式接受所需的基因表达谱作为输入,并设计出能激发所需转录组谱的类药分子。
4.5 基于化学反应
在药物发现过程中,化学合成扮演着核心角色。Dolfus等[67]提出了Synthesia,一种基于逆合成分析引导的结构修饰方法。它通过交换合成路线中的前体分子并前向合成重建,使得可生成所需的特定分子属性(如ADMET性质)且不影响可合成性的类似物。此外,Qiang等[68]提出一种通过统一模型Uni-RXN弥合化学反应预处理和条件分子生成之间差距的新方法。Uni-RXN在反应分类准确性和多种可合成分子的生成方面取得了显著改进,展示了其在简化药物发现过程方面的潜力。
4.6 基于多目标的分子生成与基于多靶点的分子生成
在药物发现过程中,不仅需提升分子的活性,还需保证分子的ADMET等成药性质。近年来,多目标分子生成方法在药物发现领域也取得了显著进展。Khemchandani等[69]提出了采用图卷积和强化学习的多目标分子生成方法DeepGraphMolGen,用于生成具有期望属性的分子。该模型使用图卷积网络(GCNs)学习从蛋白、配体结合数据(binding data)中的分子与目标的相互作用模型,并通过强化学习优化包括药物相似性和可合成性在内的多个目标。Lamanna等[70]提出的GENERA算法结合了深度学习算法DeLA-Drug和遗传算法,针对特定靶标快速生成有前景的候选分子,并通过多目标优化验证其能力。GENERA生成的聚焦库显示了与已知ACE-2结合剂相比更好的得分,证明了其在目标导向的de novo设计中的创新潜力。
4.7 分子生成模型发现的化合物
分子生成模型已在药物发现领域成为关键的研究工具,特别是在加速新药候选化合物的发现与优化过程中展现了其独特价值[71]。例如,由英国的Exscientia和住友大日本制药(Sumitomo Dainippon Pharma)共同开发的DSP-1181,作为首个由AI设计且于2020年1月在日本进入临床Ⅰ期研究的分子,是一种长效的5-HT1A受体激动剂。遗憾的是,该分子尚未披露结构且在临床Ⅰ期试验中未达到预期效果,因此已停止其开发[72]。此外,英矽智能公司运用其多模态生成式强化学习平台Chemistry42,成功鉴定TRAF相互作用激酶(TNIK)为抗纤维化靶标,并开发了小分子抑制剂INS018_055(图3-A)。该药物可以通过口服、吸入或局部应用,已在多个体内研究中证明具有显著的抗纤维化和抗炎效果,并在覆盖78名健康志愿者的随机、双盲、安慰剂对照的临床Ⅰ期试验中验证了其安全性和药代动力学。从靶点发现到药物候选仅用时18个月,体现了生成式AI药物发现流程的高效性,目前该分子正在临床Ⅱ期试验中[73]。英矽智能公司也成功优化了一系列基于氮杂环的CDK8抑制剂,经过多轮优化,这些抑制剂在体外的微粒体稳定性、激酶选择性等特性均得到显著提升。其中,先导化合物1在CDK8 LanthaScreen结合测定中显示出的卓越抑制活性,IC50为0.7 nmol/L,并在MV4-11细胞活力测试中也表现出IC50为11.8 nmol/L的优秀抑制活性(图3-B)。此外,化合物1在多个体内肿瘤模型中也展示了剂量依赖性的抑制效果,目前该分子仍在临床前研究中[74]。2024年,麦克马斯特大学与斯坦福大学的研究团队共同开发了SyntheMol模型,成功设计针对超级细菌鲍曼不动杆菌(Acinetobacter baumannii)且易于合成的分子,并成功合成了58种分子。其中6种结构新颖的分子(化合物2~7)对包括肺炎克雷伯菌在内的多种细菌病原体表现出显著的抗菌活性,并具有良好的安全性(图3-C)。然而,SyntheMol模型目前仍有局限性,如有4个分子因水溶性不足未能进入动物实验阶段[75]。尽管AI设计的分子在转化为临床应用方面仍面临挑战,但生成式AI的应用仍在不断推动着药物研发的边界。例如,英矽智能公司通过其Chemistry42平台在抗纤维化治疗领域取得的突破等。这些进展不仅彰显了AI在药物发现过程中的应用潜力,也突显了持续创新与技术改进的必要性,以克服现有挑战并最终实现新药的临床成功。
5. 结论和展望
深度生成模型已在分子生成等领域显示出巨大的潜力,尤其在计算化学、药物设计及人工智能等多学科交叉的研究领域中,这些模型在生成复杂分子结构与优化药物属性方面展示了其显著的能力。特别是变分自编码器、生成对抗网络、流模型以及扩散模型等,其在模拟和生成具有药物活性的新分子结构方面取得了重要进展。然而,这些先进模型在转化为实际应用时,仍然面临诸多挑战。这些挑战包括但不限于数据的质与量、模型的复杂性与计算成本之间的权衡、泛化能力的强弱,以及模型的可解释性、透明度和隐私保护的重要性等。
在上述背景下,模型决策过程的解释性和透明度显得尤其关键。因此,未来的研究应不仅聚焦于提升模型性能,而且应深入探讨如何优化其泛化能力、透明度等方面,以确保这些技术在实际应用中的有效性与可靠性。此外,对于药物化学空间的探索,深度生成模型有潜力打破传统的界限,提供超出现有知识库的新分子。这不仅可以加速新药的发现过程,而且有助于探索未被传统方法所涵盖的化学空间,从而揭示未知的药效关系和分子机制。有效克服当前面临的挑战,并充分利用深度生成模型的这一潜力,将极大推动药物发现和分子设计的创新,为未来的药物研发带来革命性的变化。
-
表 1 基于纳米递送系统的代表性跨BBB药物递送策略
纳米递送系统类型 递送策略设计 相关应用 参考文献 脂质纳米制剂 由淀粉样前体蛋白部分片段修饰的脂质体 一种多巴胺脑靶向治疗帕金森病(PD)的新策略 [19] 含SynO4单抗的转铁蛋白偶联脂质体 减少α-突触核蛋白聚集并改善PD行为症状 [20] 掺杂色胺衍生类脂质的脂质纳米颗粒(NT1-LNPs) 可通过静脉注射将小分子药物和生物大分子药物送入小鼠脑内的一种脂质纳米制剂修饰手段 [21] 热响应性脂质纳米颗粒(TLN) 一种安全有效的热反应性药物递送系统,具有更高的跨BBB以及靶向胶质母细胞瘤细胞的潜力 [22] 聚合物纳米颗粒 装载姜黄素(Cur)并用糖肽修饰的PLGA纳米颗粒(g7-NPs-Cur) 用于治疗阿尔茨海默病(AD)的Cur脑靶向递送系统 [23] 外部修饰甘露糖并负载芬戈莫德 (FTY)PLGA-PEGn纳米骨架(FTY@Man NP) 一种用于治疗AD的智能口服脑靶向纳米颗粒 [24] 分别在PCL-PEG末端修饰D-T7和MG1 (Asp@TMNPs) 用于治疗孤独症谱系障碍的阿司匹林胶囊级联给药系统 [25] PMPC双功能靶向性纳米载体(PAMAM-PMPC) 一种针对胶质母细胞瘤(GBM)的靶向治疗的创新化药物纳米递送策略 [26] 负载DOX的PLGA-lysoGM1胶束(PLGA-lysoGM1/DOX) 在GBM大鼠模型中有良好的抗肿瘤作用 [27] 以RGD和NIR830修饰并包被PEG-b-AGE聚合物作为递送SN38的超细磁性纳米颗粒 (NIR830-RGD-uIONP/SN38) 在GBM小鼠模型中具有良好的肿瘤靶向递送和治疗效果 [28] 磁性纳米颗粒 DPA-PEG功能化超顺磁性超小氧化铁纳米颗粒(DPA-PEGylated USPIONs) 通过捕获β-淀粉样蛋白(Aβ)有效改善血脑屏障通透性以实现AD治疗 [29] 利用OPD构建表面具有含氮多芳官能团的碳量子点(OPCDs) 作为一种多功能β-sheet结构破坏剂通过靶向Aβ治疗AD [30] 羰基纳米颗粒 多壁碳纳米管(MWCNTs) 通过刺激中枢神经系统释放一氧化氮来调节血压 [31] 无机金属纳米颗粒 靶向紧密连接的金纳米颗粒(Au NPs) 一种提高无机金属纳米颗粒跨BBB转运能力的策略 [32] 利用Opca蛋白表面修饰并包载MTX的MnO2 NPs(MTX@MnO2-Opca) 一种能有效克服BBB并治疗GBM的仿生纳米递送系统 [33] -
[1] Sweeney MD, Sagare AP, Zlokovic BV. Blood-brain barrier breakdown in Alzheimer disease and other neurodegenerative disorders[J]. Nat Rev Neurol, 2018, 14(3): 133-150.
[2] Liebner S, Dijkhuizen RM, Reiss Y, et al. Functional morphology of the blood-brain barrier in health and disease[J]. Acta Neuropathol, 2018, 135(3): 311-336. doi: 10.1007/s00401-018-1815-1
[3] Terstappen GC, Meyer AH, Bell RD, et al. Strategies for delivering therapeutics across the blood-brain barrier[J]. Nat Rev Drug Discov, 2021, 20(5): 362-383. doi: 10.1038/s41573-021-00139-y
[4] Furtado D, Björnmalm M, Ayton S, et al. Overcoming the blood-brain barrier: the role of nanomaterials in treating neurological diseases[J]. Adv Mater, 2018, 30(46): e1801362. doi: 10.1002/adma.201801362
[5] Ding SC, Khan AI, Cai XL, et al. Overcoming blood-brain barrier transport: advances in nanoparticle-based drug delivery strategies[J]. Mater Today, 2020, 37: 112-125. doi: 10.1016/j.mattod.2020.02.001
[6] Zhou YT, Zhu FY, Liu Y, et al. Blood-brain barrier-penetrating siRNA nanomedicine for Alzheimer’s disease therapy[J]. Sci Adv, 2020, 6(41): eabc7031. doi: 10.1126/sciadv.abc7031
[7] Jiang XY, Andjelkovic AV, Zhu L, et al. Blood-brain barrier dysfunction and recovery after ischemic stroke[J]. Prog Neurobiol, 2018, 163/164: 144-171. doi: 10.1016/j.pneurobio.2017.10.001
[8] Brown LS, Foster CG, Courtney JM, et al. Pericytes and neurovascular function in the healthy and diseased brain[J]. Front Cell Neurosci, 2019, 13: 282.
[9] Sweeney MD, Ayyadurai S, Zlokovic BV. Pericytes of the neurovascular unit: key functions and signaling pathways[J]. Nat Neurosci, 2016, 19(6): 771-783. doi: 10.1038/nn.4288
[10] Heithoff BP, George KK, Phares AN, et al. Astrocytes are necessary for blood-brain barrier maintenance in the adult mouse brain[J]. Glia, 2021, 69(2): 436-472. doi: 10.1002/glia.23908
[11] Agrawal M, Saraf S, Saraf S, et al. Recent strategies and advances in the fabrication of nano lipid carriers and their application towards brain targeting[J]. J Control Release, 2020, 321: 372-415. doi: 10.1016/j.jconrel.2020.02.020
[12] Cheng JM, Li JX, Duan XP. Applications of ferritin-based delivery system in biomedical field[J]. J China Pharm Univ (中国药科大学学报), 2024, 55(4): 530-537. doi: 10.1016/j.xphs.2017.04.036 Cheng JM, Li JX, Duan XP. Applications of ferritin-based delivery system in biomedical field[J]. J China Pharm Univ (中国药科大学学报), 2024, 55(4): 530-537. doi: 10.1016/j.xphs.2017.04.036
[13] Huang QQ, Jiang CQ, Xia X, et al. Pathological BBB crossing melanin-like nanoparticles as metal-ion chelators and neuroinflammation regulators against Alzheimer’s disease[J]. Research, 2023, 6: 0180. doi: 10.34133/research.0180
[14] Luo Q, Lin YX, Yang PP, et al. A self-destructive nanosweeper that captures and clears amyloid β-peptides[J]. Nat Commun, 2018, 9(1): 1802. doi: 10.1038/s41467-018-04255-z
[15] Song YH, De R, Lee KT. Emerging strategies to fabricate polymeric nanocarriers for enhanced drug delivery across blood-brain barrier: an overview[J]. Adv Colloid Interface Sci, 2023, 320: 103008. doi: 10.1016/j.cis.2023.103008
[16] Kisler K, Nelson AR, Montagne A, et al. Cerebral blood flow regulation and neurovascular dysfunction in Alzheimer disease[J]. Nat Rev Neurosci, 2017, 18(7): 419-434. doi: 10.1038/nrn.2017.48
[17] Longden TA, Dabertrand F, Koide M, et al. Capillary K+-sensing initiates retrograde hyperpolarization to increase local cerebral blood flow[J]. Nat Neurosci, 2017, 20(5): 717-726. doi: 10.1038/nn.4533
[18] The intersection of bottom-up synthetic cell engineering and nanobiotechnology[J]. Nat Nanotechnol, 2024, 19(2): 131.
[19] Kahana M, Weizman A, Gabay M, et al. Liposome-based targeting of dopamine to the brain: a novel approach for the treatment of Parkinson’s disease[J]. Mol Psychiatry, 2021, 26(6): 2626-2632. doi: 10.1038/s41380-020-0742-4
[20] Sela M, Poley M, Mora-Raimundo P, et al. Brain-targeted liposomes loaded with monoclonal antibodies reduce alpha-synuclein aggregation and improve behavioral symptoms in Parkinson’s disease[J]. Adv Mater, 2023, 35(51): e2304654. doi: 10.1002/adma.202304654
[21] Ma FH, Yang L, Sun ZR, et al. Neurotransmitter-derived lipidoids (NT-lipidoids) for enhanced brain delivery through intravenous injection[J]. Sci Adv, 2020, 6(30): eabb4429. doi: 10.1126/sciadv.abb4429
[22] Rehman M, Madni A, Shi D, et al. Enhanced blood brain barrier permeability and glioblastoma cell targeting via thermoresponsive lipid nanoparticles[J]. Nanoscale, 2017, 9(40): 15434-15440. doi: 10.1039/C7NR05216B
[23] Barbara R, Belletti D, Pederzoli F, et al. Novel curcumin loaded nanoparticles engineered for blood-brain barrier crossing and able to disrupt Aβ aggregates[J]. Int J Pharm, 2017, 526(1/2): 413-424.
[24] Dhar D, Ghosh S, Das S, et al. A review of recent advances in magnetic nanoparticle-based theranostics of glioblastoma[J]. Nanomed-Nanotechnol Biol Med, 2022, 17(2): 107-132.
[25] He XQ, Xie J, Zhang J, et al. Acid-responsive dual-targeted nanoparticles encapsulated aspirin rescue the immune activation and phenotype in autism spectrum disorder[J]. Adv Sci, 2022, 9(14): e2104286. doi: 10.1002/advs.202104286
[26] Ban JM, Li SD, Zhan Q, et al. PMPC modified PAMAM dendrimer enhances brain tumor-targeted drug delivery[J]. Macromol Biosci, 2021, 21(4): e2000392. doi: 10.1002/mabi.202000392
[27] Yin Y, Wang J, Yang M, et al. Penetration of the blood-brain barrier and the anti-tumour effect of a novel PLGA-lysoGM1/DOX micelle drug delivery system[J]. Nanoscale, 2020, 12(5): 2946-2960. doi: 10.1039/C9NR08741A
[28] Li YC, Xie MM, Jones JB, et al. Targeted delivery of DNA topoisomerase inhibitor SN38 to intracranial tumors of glioblastoma using sub-5 ultrafine iron oxide nanoparticles[J]. Adv Healthc Mater, 2022, 11(14): e2102816. doi: 10.1002/adhm.202102816
[29] Cai J, Dao P, Chen HX, et al. Ultrasmall superparamagnetic iron oxide nanoparticles-bound NIR dyes: novel theranostic agents for Alzheimer’s disease[J]. Dyes Pigm, 2020, 173: 107968. doi: 10.1016/j.dyepig.2019.107968
[30] Chung YJ, Lee BI, Park CB. Multifunctional carbon dots as a therapeutic nanoagent for modulating Cu(II)-mediated β-amyloid aggregation[J]. Nanoscale, 2019, 11(13): 6297-6306. doi: 10.1039/C9NR00473D
[31] Ahlawat J, Guillama Barroso G, Masoudi Asil S, et al. Nanocarriers as potential drug delivery candidates for overcoming the blood-brain barrier: challenges and possibilities[J]. ACS Omega, 2020, 5(22): 12583-12595. doi: 10.1021/acsomega.0c01592
[32] Li XQ, Vemireddy V, Cai Q, et al. Reversibly modulating the blood-brain barrier by laser stimulation of molecular-targeted nanoparticles[J]. Nano Lett, 2021, 21(22): 9805-9815. doi: 10.1021/acs.nanolett.1c02996
[33] Dong CY, Huang QX, Cheng H, et al. Neisseria meningitidis opca protein/MnO2 hybrid nanoparticles for overcoming the blood-brain barrier to treat glioblastoma[J]. Adv Mater, 2022, 34(12): e2109213.
[34] Gurudevan S, Kanwar RK, Veedu RN, et al. Targeted multimodal liposomes for nano-delivery and imaging: an avenger for drug resistance and cancer[J]. Curr Gene Ther, 2013, 13(5): 322-334. doi: 10.2174/156652321305131212123558
[35] Gu WC, Luozhong SJ, Cai SM, et al. Extracellular vesicles incorporating retrovirus-like capsids for the enhanced packaging and systemic delivery of mRNA into neurons[J]. Nat Biomed Eng, 2024, 8(4): 415-426. doi: 10.1038/s41551-023-01150-x
[36] Khan N, Shah FA, Rana I, et al. Nanostructured lipid carriers-mediated brain delivery of carbamazepine for improved in vivo anticonvulsant and anxiolytic activity[J]. Int J Pharm, 2020, 577: 119033. doi: 10.1016/j.ijpharm.2020.119033
[37] Mojarad-Jabali S, Farshbaf M, Walker PR, et al. An update on actively targeted liposomes in advanced drug delivery to glioma[J]. Int J Pharm, 2021, 602: 120645. doi: 10.1016/j.ijpharm.2021.120645
[38] Kong DH, Hong WY, Yu M, et al. Multifunctional targeting liposomes of epirubicin plus resveratrol improved therapeutic effect on brain gliomas[J]. Int J Nanomedicine, 2022, 17: 1087-1110. doi: 10.2147/IJN.S346948
[39] Qu MK, Lin Q, He SS, et al. A brain targeting functionalized liposomes of the dopamine derivative N-3,4-bis(pivaloyloxy)-dopamine for treatment of Parkinson’s disease[J]. J Control Release, 2018, 277: 173-182. doi: 10.1016/j.jconrel.2018.03.019
[40] Hald Albertsen C, Kulkarni JA, Witzigmann D, et al. The role of lipid components in lipid nanoparticles for vaccines and gene therapy[J]. Adv Drug Deliv Rev, 2022, 188: 114416. doi: 10.1016/j.addr.2022.114416
[41] Sun D, Lu ZR. Structure and function of cationic and ionizable lipids for nucleic acid delivery[J]. Pharm Res, 2023, 40(1): 27-46. doi: 10.1007/s11095-022-03460-2
[42] Khare P, Edgecomb SX, Hamadani CM, et al. Lipid nanoparticle-mediated drug delivery to the brain[J]. Adv Drug Deliv Rev, 2023, 197: 114861. doi: 10.1016/j.addr.2023.114861
[43] Liu SH, Liu J, Li HS, et al. An optimized ionizable cationic lipid for brain tumor-targeted siRNA delivery and glioblastoma immunotherapy[J]. Biomaterials, 2022, 287: 121645. doi: 10.1016/j.biomaterials.2022.121645
[44] Khan AR, Yang XY, Fu MF, et al. Recent progress of drug nanoformulations targeting to brain[J]. J Control Release, 2018, 291: 37-64. doi: 10.1016/j.jconrel.2018.10.004
[45] Zhou YQ, Peng ZL, Seven ES, et al. Crossing the blood-brain barrier with nanoparticles[J]. J Control Release, 2018, 270: 290-303. doi: 10.1016/j.jconrel.2017.12.015
[46] Jose S, Juna BC, Cinu TA, et al. Carboplatin loaded Surface modified PLGA nanoparticles: Optimization, characterization, and in vivo brain targeting studies[J]. Colloids Surf B Biointerfaces, 2016, 142: 307-314. doi: 10.1016/j.colsurfb.2016.02.026
[47] Koffie RM, Farrar CT, Saidi LJ, et al. Nanoparticles enhance brain delivery of blood-brain barrier-impermeable probes for in vivo optical and magnetic resonance imaging[J]. Proc Natl Acad Sci U S A, 2011, 108(46): 18837-18842. doi: 10.1073/pnas.1111405108
[48] Li W, Qiu JH, Li XL, et al. BBB pathophysiology-independent delivery of siRNA in traumatic brain injury[J]. Sci Adv, 2021, 7(1): eabd6889. doi: 10.1126/sciadv.abd6889
[49] Israel LL, Galstyan A, Holler E, et al. Magnetic iron oxide nanoparticles for imaging, targeting and treatment of primary and metastatic tumors of the brain[J]. J Control Release, 2020, 320: 45-62. doi: 10.1016/j.jconrel.2020.01.009
[50] Qiao RR, Jia QJ, Hüwel S, et al. Receptor-mediated delivery of magnetic nanoparticles across the blood-brain barrier[J]. ACS Nano, 2012, 6(4): 3304-3310. doi: 10.1021/nn300240p
[51] Liu H, Zhang J, Chen X, et al. Application of iron oxide nanoparticles in glioma imaging and therapy: from bench to bedside[J]. Nanoscale, 2016, 8(15): 7808-7826. doi: 10.1039/C6NR00147E
[52] Shen C, Wang XX, Zheng ZX, et al. Doxorubicin and indocyanine green loaded superparamagnetic iron oxide nanoparticles with PEGylated phospholipid coating for magnetic resonance with fluorescence imaging and chemotherapy of glioma[J]. Int J Nanomedicine, 2019, 14: 101-117.
[53] Peng YM, Zhan MS, Karpus A, et al. Brain delivery of biomimetic phosphorus dendrimer/antibody nano complexes for enhanced glioma immunotherapy via immune modulation of T cells and natural killer cells[J]. ACS Nano, 2024, 18(14): 10142-10155. doi: 10.1021/acsnano.3c13088
[54] Wakaskar RR. General overview of lipid-polymer hybrid nanoparticles, dendrimers, micelles, liposomes, spongosomes and cubosomes[J]. J Drug Target, 2018, 26(4): 311-318. doi: 10.1080/1061186X.2017.1367006
[55] Teng YM, Jin HQ, Nan D, et al. In vivo evaluation of urokinase-loaded hollow nanogels for sonothrombolysis on suture embolization-induced acute ischemic stroke rat model[J]. Bioact Mater, 2017, 3(1): 102-109.
[56] Hou K, Zhao J, Wang H, et al. Chiral gold nanoparticles enantioselectively rescue memory deficits in a mouse model of Alzheimer’s disease[J]. Nat Commun, 2020, 11(1): 4790. doi: 10.1038/s41467-020-18525-2
[57] Abla KK, Mehanna MM. The battle of lipid-based nanocarriers against blood-brain barrier: a critical review[J]. J Drug Target, 2023, 31(8): 832-857. doi: 10.1080/1061186X.2023.2247583
[58] Mu Y,Zhao HM,Liu HC,et al.Advances in drug development for Alzheimer’s disease [J/OL].J China Pharm Univ (中国药科大学学报). [2024-08-25].https://link.cnki.net/urlid/32.1157.R.20240528.1404.006. Mu Y, Zhao HM, Liu HC,et al.Advances in drug development for Alzheimer’s disease [J/OL].J China Pharm Univ (中国药科大学学报). [2024-08-25].https://link.cnki.net/urlid/32.1157.R.20240528.1404.006.
[59] Zha S, Liu HT, Li HD, et al. Functionalized nanomaterials capable of crossing the blood-brain barrier[J]. ACS Nano, 2024, 18(3): 1820-1845. doi: 10.1021/acsnano.3c10674
[60] Farfara D, Sooliman M, Avrahami L, et al. Physiological expression of mutated TAU impaired astrocyte activity and exacerbates β-amyloid pathology in 5xFAD mice[J]. J Neuroinflammation, 2023, 20(1): 174. doi: 10.1186/s12974-023-02823-9
[61] Martins PAT, Alsaiari S, Julfakyan K, et al. Self-assembled lipoprotein based gold nanoparticles for detection and photothermal disaggregation of β-amyloid aggregates[J]. Chem Commun, 2017, 53(13): 2102-2105. doi: 10.1039/C6CC09085K
[62] Liu YL, Ai KL, Ji XY, et al. Comprehensive insights into the multi-antioxidative mechanisms of melanin nanoparticles and their application to protect brain from injury in ischemic stroke[J]. J Am Chem Soc, 2017, 139(2): 856-862. doi: 10.1021/jacs.6b11013
[63] Nitzsche F, Müller C, Lukomska B, et al. Concise review: MSC adhesion cascade-insights into homing and transendothelial migration[J]. Stem Cells, 2017, 35(6): 1446-1460. doi: 10.1002/stem.2614
[64] Jin Y, Tang ZY, Shang S, et al. A nanodisc-paved biobridge facilitates stem cell membrane fusogenicity for intracerebral shuttling and bystander effects[J]. Adv Mater, 2023, 35(40): e2302367. doi: 10.1002/adma.202302367
[65] Cheng GW, Liu YJ, Ma R, et al. Anti-parkinsonian therapy: strategies for crossing the blood-brain barrier and nano-biological effects of nanomaterials[J]. Nanomicro Lett, 2022, 14(1): 105.
[66] de Rus Jacquet A, Alpaugh M, Denis HL, et al. The contribution of inflammatory astrocytes to BBB impairments in a brain-chip model of Parkinson’s disease[J]. Nat Commun, 2023, 14(1): 3651. doi: 10.1038/s41467-023-39038-8
[67] Paul G, Elabi OF. Microvascular changes in Parkinson’s disease- focus on the neurovascular unit[J]. Front Aging Neurosci, 2022, 14: 853372. doi: 10.3389/fnagi.2022.853372
[68] da Rocha Lindner G, Bonfanti Santos D, Colle D, et al. Improved neuroprotective effects of resveratrol-loaded polysorbate 80-coated poly(lactide) nanoparticles in MPTP-induced Parkinsonism[J]. Nanomed-Nanotechnol Biol Med, 2015, 10(7): 1127-1138.
[69] Kumar A, Chaudhary RK, Singh R, et al. Nanotheranostic applications for detection and targeting neurodegenerative diseases[J]. Front Neurosci, 2020, 14: 305. doi: 10.3389/fnins.2020.00305
[70] Huang FY, Chen WJ, Lee WY, et al. In vitro and in vivo evaluation of lactoferrin-conjugated liposomes as a novel carrier to improve the brain delivery[J]. Int J Mol Sci, 2013, 14(2): 2862-2874.
[71] Katila N, Duwa R, Bhurtel S, et al. Enhancement of blood-brain barrier penetration and the neuroprotective effect of resveratrol[J]. J Control Release, 2022, 346: 1-19. doi: 10.1016/j.jconrel.2022.04.003
[72] El-Agnaf O, Overk C, Rockenstein E, et al. Differential effects of immunotherapy with antibodies targeting α-synuclein oligomers and fibrils in a transgenic model of synucleinopathy[J]. Neurobiol Dis, 2017, 104: 85-96. doi: 10.1016/j.nbd.2017.05.002
[73] Yu YJ, Zhang Y, Kenrick M, et al. Boosting brain uptake of a therapeutic antibody by reducing its affinity for a transcytosis target[J]. Sci Transl Med, 2011, 3(84): 84ra44.
[74] Sim HW, Morgan ER, Mason WP. Contemporary management of high-grade gliomas[J]. CNS Oncol, 2018, 7(1): 51-65. doi: 10.2217/cns-2017-0026
[75] Sarkaria JN, Hu LS, Parney IF, et al. Is the blood-brain barrier really disrupted in all glioblastomas? A critical assessment of existing clinical data[J]. Neuro Oncol, 2018, 20(2): 184-191. doi: 10.1093/neuonc/nox175
[76] Arvanitis CD, Ferraro GB, Jain RK. The blood-brain barrier and blood-tumour barrier in brain tumours and metastases[J]. Nat Rev Cancer, 2020, 20(1): 26-41. doi: 10.1038/s41568-019-0205-x
[77] Dubois LG, Campanati L, Righy C, et al. Gliomas and the vascular fragility of the blood brain barrier[J]. Front Cell Neurosci, 2014, 8: 418.
[78] van Tellingen O, Yetkin-Arik B, de Gooijer MC, et al. Overcoming the blood-brain tumor barrier for effective glioblastoma treatment[J]. Drug Resist Updat, 2015, 19: 1-12. doi: 10.1016/j.drup.2015.02.002
[79] Ma XT, Aravind A, Pfister BJ, et al. Animal models of traumatic brain injury and assessment of injury severity[J]. Mol Neurobiol, 2019, 56(8): 5332-5345. doi: 10.1007/s12035-018-1454-5
[80] Wang JJ, Ni QK, Wang YF, et al. Nanoscale drug delivery systems for controllable drug behaviors by multi-stage barrier penetration[J]. J Control Release, 2021, 331: 282-295. doi: 10.1016/j.jconrel.2020.08.045
-
期刊类型引用(2)
1. 冯馨锐,吴韦铷,张晓丽,杨忠,邓有才,毕清华. 人工智能在临床血液学检验教学中的应用. 中华检验医学杂志. 2025(02): 286-291 .  百度学术
百度学术
2. 陈雨欣,付慧,赵熠,徐芳芳,沈甫明. 主动脉夹层发病机制的研究进展. 同济大学学报(医学版). 2025(02): 292-299 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: