摘要
为探索甘草甜素(glycyrrhizin,GL)对糖尿病视网膜病变(diabetic retinopathy,DR)的潜在抗炎作用和视网膜神经保护作用,21只雄性C57BL/6小鼠随机分为对照组(Control)、模型组(Model)、甘草甜素(GL)组。采用STZ腹腔注射建立糖尿病小鼠模型。GL组在建模后用GL(150 mg/kg/d)灌胃治疗6周。视网膜组织切片,石蜡包埋,用苏木精-伊红(HE)进行形态学检查。免疫组化检测组织GLUT1、GFAP和GAP43表达,RT-PCR检测视网膜炎症和凋亡介质的表达(TNF-α、IL6、iNOS、NF-κB和Tp53)。结果显示,糖尿病小鼠视网膜发育紊乱,视网膜层衰弱,胶质细胞增生标志物GFAP表达上调,神经元可塑性标志物GAP43表达下调;糖尿病小鼠视网膜上的NF-κB、TNF-α、IL6、iNOS和Tp53转录增加。GL组减轻了糖尿病小鼠视网膜上的GLUT1表达的下调程度,视网膜炎症消除,且结构有所改善。上述结果提示GL可能对糖尿病患者具有神经保护和抗炎作用,但其对DR患者是否有效安全需要进一步的临床研究证实。
糖尿病视网膜病变(diabetic retinopathy,DR)是一种与糖尿病相关的神经退行性并发症,是成年人早期视力下降甚至致盲的主要原
甘草甜素(glycyrrhizin,GL)是一种天然的抗炎和抗真菌因子。它通过抑制高迁移率族蛋白B1(high mobility group box 1 protein,HMGB1)对中枢神经系统疾病起到保护作
甘草甜素(glycyrrhizin,GL)及链脲佐菌素(streptozotocin,STZ)(美国Sigma Aldrich公司);One Touch Horizon血糖仪[强生(中国)医疗器材有限公司];磷酸盐缓冲液(PBS)、一抗GFAP、第一链cDNA合成试剂盒(美国赛默飞世尔公司);GAP43和GLUT-1(英国Abcam),生物素标记的二抗、DAB辣根过氧化物酶显色试剂盒(P0202)、TRIzol试剂(上海碧云天生物技术有限公司)。
OneTouch Ultra自动血糖仪(强生医疗器械有限公司);Olympus CX21光学显微镜(日本Olympus公司);ABI 7500实时PCR系统(美国Applied Biosystems公司)。
小鼠随机分为对照组(Control)、模型组(Model)及甘草甜素(GL)组,每组7只。对照组小鼠注射生理盐水,模型组及GL组用STZ(60 mg/kg)单剂量腹腔注射,72 h后取小鼠尾静脉血,用自动血糖仪检测血糖不低于16.7 mmol/L,证实建模成功。建模成功后GL组灌胃给予GL(150 mg/kg/d),持续5周。对照组及模型组用等剂量的生理盐水灌胃。实验结束时,断头法处死小鼠,取眼球并解剖得到视网膜组织进行组织病理学研究、免疫组化和RT-PCR检测。
视网膜组织用福尔马林固定,石蜡包埋,用于组织病理学检查。5 μm厚度切片进行脱蜡,逐级酒精脱水,伊红染色。观察切片形态学变化。采用光学显微镜400×透镜进行视网膜总厚度、外核层(outer nuclear layer,ONL)厚度、内核层(inner nuclear layer,INL)厚度测量和神经节细胞层细胞计数(ganglion cell layer,GCL) 等形态学分
将福尔马林固定石蜡包埋的组织切片(4 μm)安装在带正电荷的载玻片上,进行免疫组化染色。视网膜切片用3% H2O2孵育10 min,PBS冲洗5 min,用一抗GFAP(1∶100)、GAP43(1∶500)和GLUT1 (1∶250)孵育,4 ℃过夜。PBS冲洗,生物素标记的二抗室温孵育30 min,DAB辣根过氧化物酶显色试剂盒染色,再用苏木精进行复染。光学显微镜观察星形细胞突起和视网膜层上GFAP和GAP43的表达。GLUT-1染色强度根据不同视网膜层的相对染色强度,对视网膜切片进行半定量评分 (0 ~ 3+
根据制造商的说明,使用TRIzol试剂从冷冻组织中提取总RNA。使用第一链cDNA合成试剂盒将RNA转化为cDNA。使用实时PCR系统进行实时PCR。引物序列详见
如
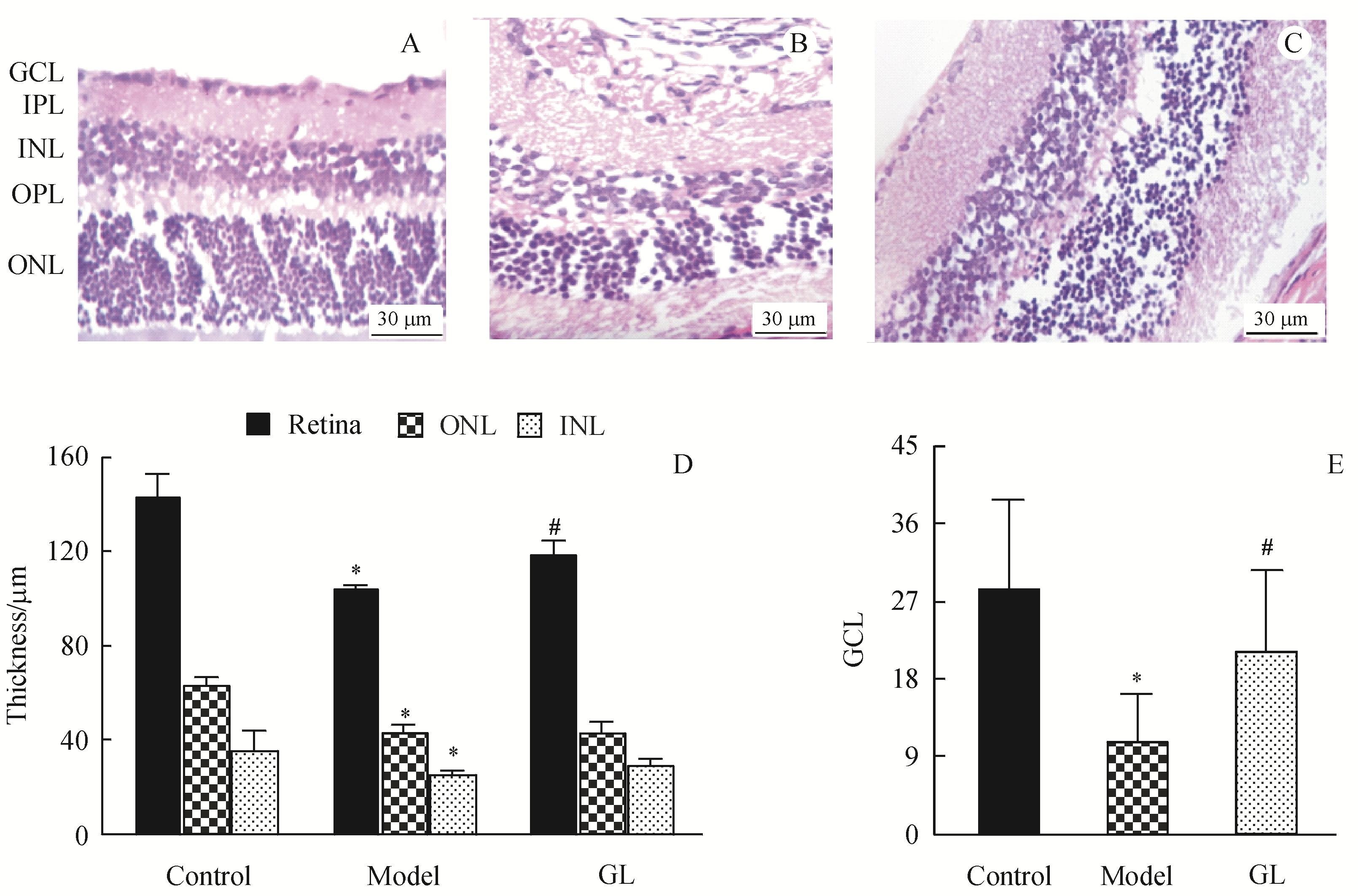
Figure 1 Histopathological effects of glycyrrhizin (GL) on diabetic retina (400×)
A:Control;B:Model;C:GL group;D:Total retinal thickness,INL thickness,ONL thickness,E:Number of retinal ganglion cells () ONL:Outer nuclear layer;INL:Inner nuclear layer;GCL:Ganglion cell layer;GL:Glycyrrhizin
GLUT1染色切片的免疫组化图像如
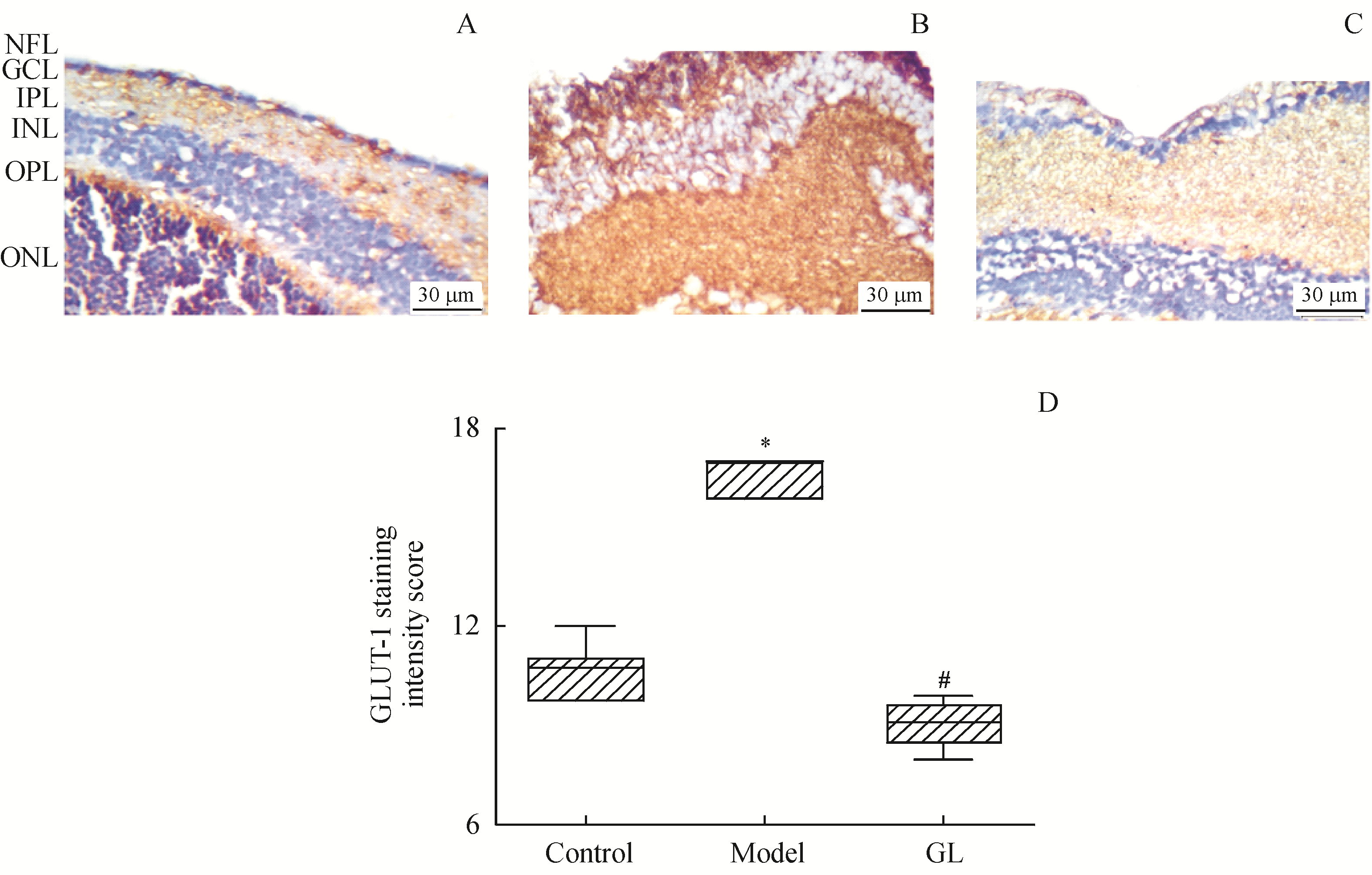
Figure 2 Immunohistochemical staining of GLUT1 in mouse retinas
A:Control;B:Model;C:GL group;D:GLUT-1 staining intensity score ()
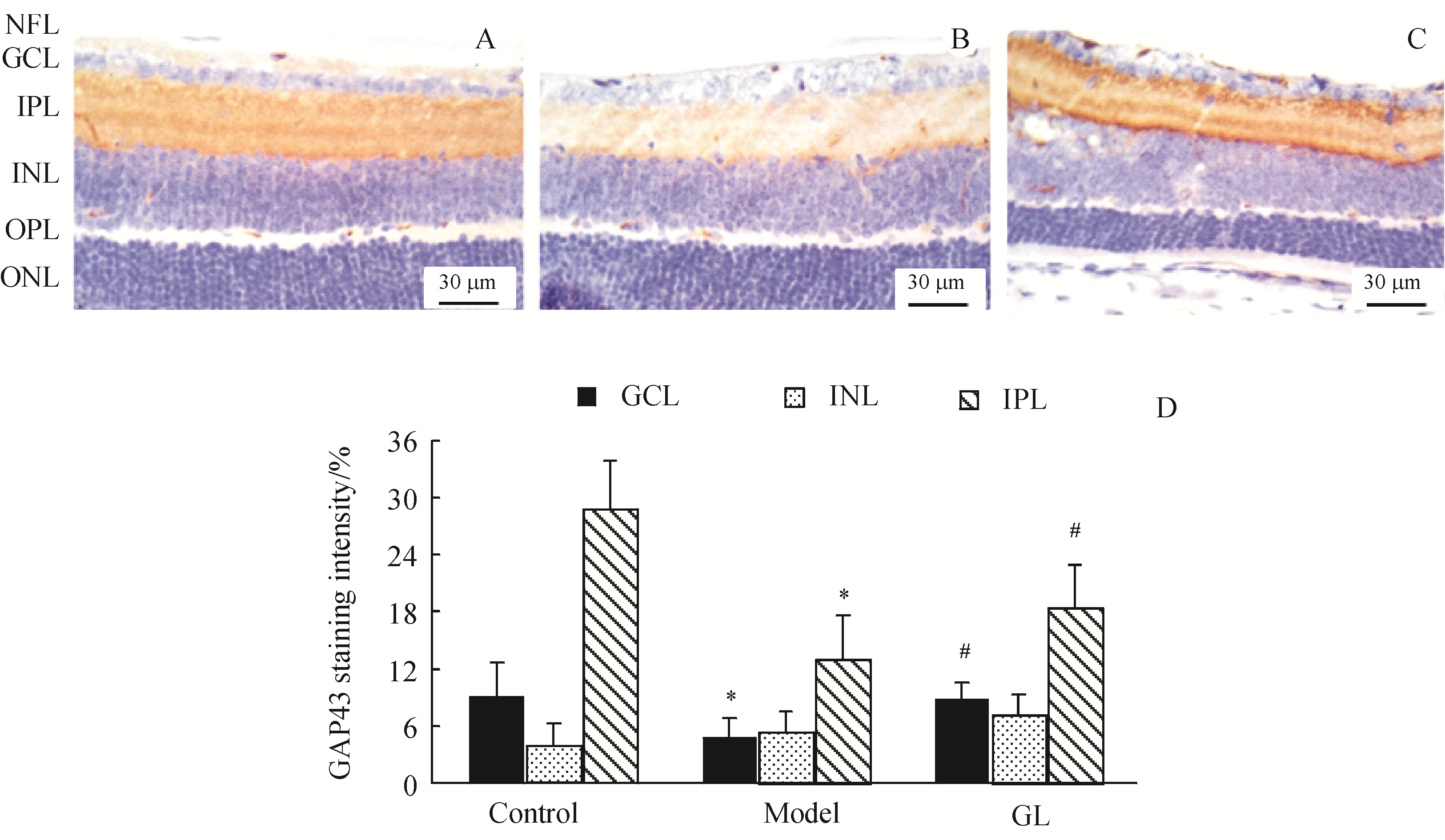
Figure 3 Immunohistochemical staining of GAP43 in mouse retinas
A:Control;B:Model ;C:GL group;D:GAP43 staining intensity ()
GFAP免疫染色见
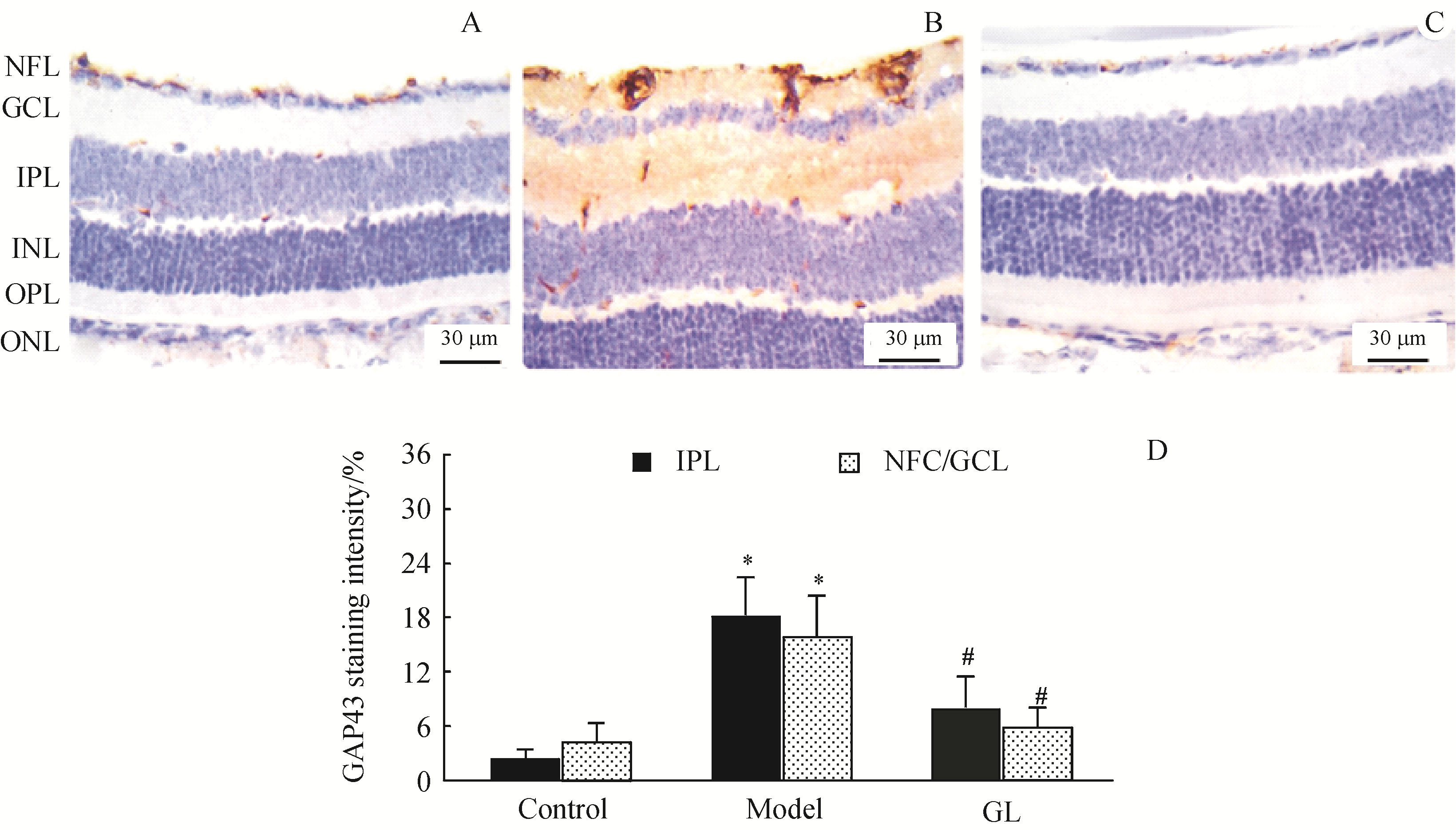
Figure 4 Immunohistochemical staining of GFAP in mouse retinas
A:Control;B:Model;C:GL group;D:GAP43 staining intensity ()
在糖尿病动物模型中,视网膜组织中出现炎症、氧化和增殖标志物的异常表达,见
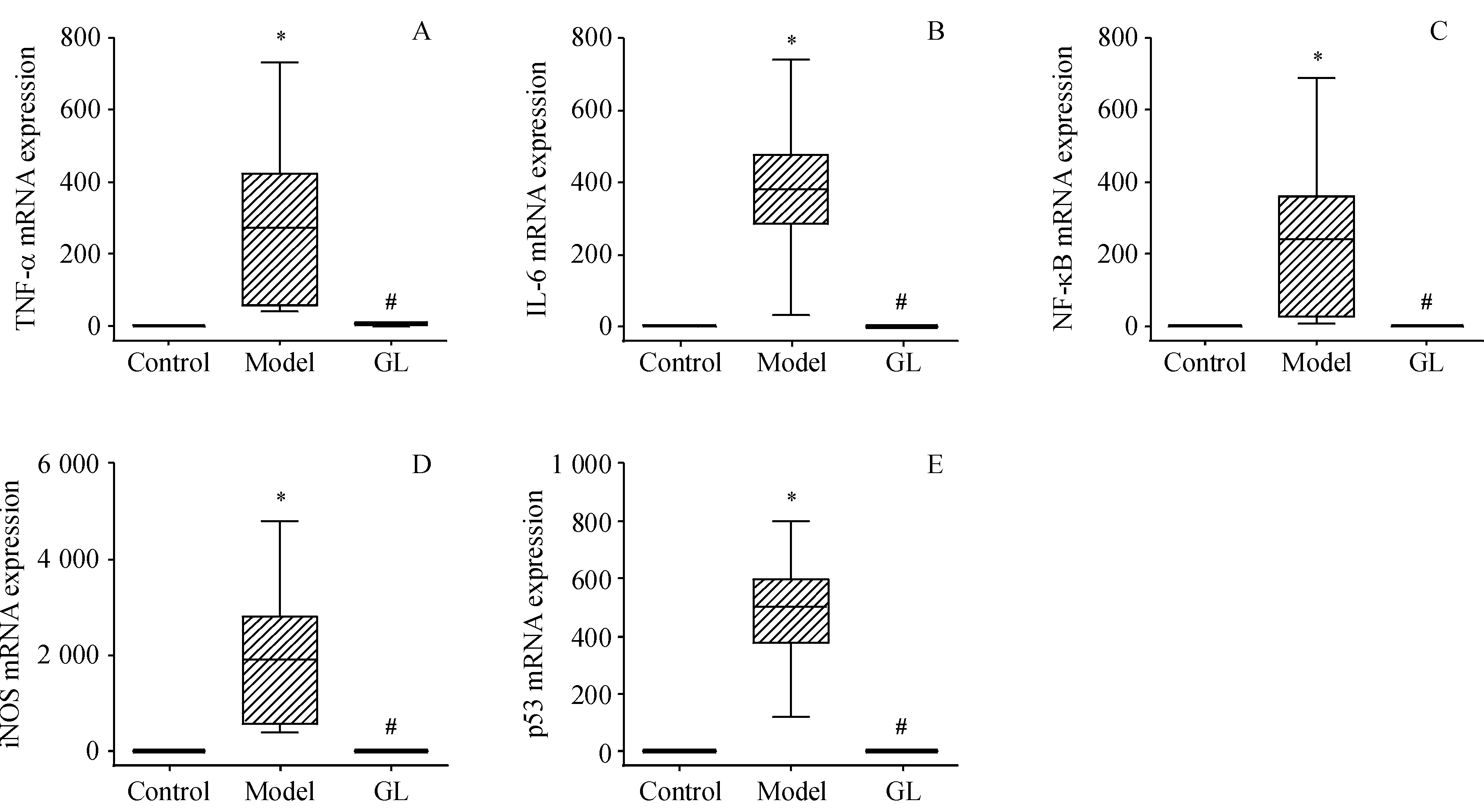
Figure 5 mRNA expression of inflammatory and apoptotic mediators in mouse retinas ()
A:TNF-α;B:IL-6;C:NF-κB;D:iNOS;E:Tp53
DR是一种进展缓慢的疾病,出现临床症状需要数年时
高血糖诱导的氧化应激和炎症反应是DR发病的主要原
此外,GL还下调了糖尿病小鼠中神经元应激指标和胶质细胞活化标志物GFAP,而上调了神经元再生标记物GAP43。GAP43定位于轴突生长锥,参与神经系统突触的可塑性,在糖尿病大鼠中GAP43下
综上所述,本试验研究结果显示,在DR的实验模型中,甘草甜素主要发挥其抗炎和神经保护作用,提示GL在DR的病例中可能具有良好的应用前景。
参 考 文 献
Zhang JH,Chen XL. Diagnosis and treatment of diabetic retinopathy:the latest research progress in the year of 2016-2018[J]. Recent Advs Ophthalmol (眼科新进展),2018,38(12):91‒96. [百度学术]
Gubitosi-Klug RA. The diabetes control and complications trial/epidemiology of diabetes interventions and complications study at 30 years:summary and future directions[J]. Diabetes Care,2014,37(1):44‒49. [百度学术]
Morales-Sosa M,Orozco-Suarez S,Vega-Garcia A,et al. Immunomodulatory effect of Celecoxib on HMGB1/TLR4 pathway in a recurrent seizures model in immature rats[J]. Pharmacol Biochem Behav,2018,170(5):79‒86. [百度学术]
Wang L,Li YJ,Zhang b,et al. Protective effects and mechanism of glycyrrhizin on status epilepticus rats[J]. J Apoplexy Nerv Dis (中风与神经疾病杂志),2017,34(10):897‒901. [百度学术]
Liu L,Jiang Y,Steinle JJ. Inhibition of HMGB1 protects the retina from ischemia-reperfusion,as well as reduces insulin resistance proteins[J]. PLoS One,2017,12(5):e0178236. [百度学术]
Nasiry D,Khalatbary AR,Ahmadvand H. Therapeutic potential of Juglans regia L. leaf extract against diabetic retinopathy in rat[J]. Iran J Basic Med Sci,2017,20(11):1275‒1281. [百度学术]
Kumagai AK,Glasgow BJ,Pardridge WM. GLUT1 glucose transporter expression in the diabetic and nondiabetic human eye[J]. Invest Ophth Vis Sci,1994,35(6):2887‒2894. [百度学术]
Kawasaki R,Konta T,Nishida K. Lipid-lowering medication is associated with decreased risk of diabetic retinopathy and the need for treatment in patients with type 2 diabetes:a real-world observational analysis of a health claims database[J]. Diabetes Obes Metab,2018,20(10):2351‒2360. [百度学术]
Elmasry K,Ibrahim AS,Saleh H,et al. Role of endoplasmic reticulum stress in 12/15-lipoxygenase-induced retinal microvascular dysfunction in a mouse model of diabetic retinopathy[J]. Diabetologia,2018,61(5):1220‒1232. [百度学术]
Bai Y,He Y,Yang LX. Mechanism of traditional Chinese medicine for promoting blood circulation and removing blood stasis in treating diabetic nephropathy[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志),2018,24(23):200‒206. [百度学术]
Dehdashtian E,Mehrzadi S,Yousefi B,et al. Diabetic retinopathy pathogenesis and the ameliorating effects of melatonin; involvement of autophagy,inflammation and oxidative stress[J]. Life Sci,2017,193(9):20‒33. [百度学术]
You ZP,Zhang YL,Shi K,et al. Suppression of diabetic retinopathy with GLUT1 siRNA[J]. Sci Rep,2017,7(1):7437‒7447. [百度学术]
Thorens B,Mueckler M. Glucose transporters in the 21st century[J]. Am J Physiol Endocrinol Metab,2010,298(2):E141‒E145. [百度学术]
Jianwei Z,Lingling W,Shucai L,et al. Expression changes of growth-associated protein-43 (GAP-43) and mitogen-activated protein kinase phosphatase-1 (MKP-1) and in hippocampus of streptozotocin-induced diabetic cognitive impairment rats[J]. Exp Neurol,2007,206(2):201‒208. [百度学术]
Li ZW,Liang HM,Li Z,et al. The protective effect of rosiglitazone on diabetic retinal Müller cells and its effects on the expression of glial fibrillary acidic protein (GFAP) and inflammatory factors in Müller cells[J]. Recent Advs Ophthalmol(眼科新进展),2018,38(9):825‒828. [百度学术]
Liu L, Jiang Y, Steinle JJ. Glycyrrhizin protects the diabetic retina against permeability,neuronal,and vascular damage through anti-Inflammatory mechanisms[J]. J Clin Med,2019,8(7):957‒963. [百度学术]
Chen JH. Neuroprotective effect and the mechanism of glycyrrhizin on hippocampal in infant rats with temporal lobe epilepsy(甘草甜素对幼鼠颞叶癫痫海马神经元的保护作用及其机制研究)[D].Zhengzhou University(郑州大学),2017. [百度学术]
Holm TH,Dina D,Trevor O. Microglia are required for astroglial Toll-like receptor 4 response and for optimal TLR2 and TLR3 response[J]. Glia,2012,60(4):630‒638. [百度学术]