摘要
近红外光免疫治疗(NIR-PIT)是一种高选择性分子靶向的肿瘤光学治疗手段。它通过给予水溶性近红外硅酞菁染料IRDye700DX与靶向肿瘤细胞表面抗原的单克隆抗体的结合物,然后局部给予近红外光特异性地诱导肿瘤细胞的快速死亡。基于NIR-PIT良好的临床转化前景,本文从其影响因素、抗肿瘤作用机制、存在问题与对策等方面进行综述,旨在为其研究及临床应用提供参考。
光动力学治疗(photodynamic therapy,PDT)是将光吸收剂与非电离光的物理能相结合进而杀死细胞。但是,它在肿瘤治疗中并不常用,原因是非靶向的光吸收剂也能够被正常组织摄取,经光照后即可引发严重的副作
近红外光免疫治疗(near infrared photoimmunotherapy,NIR-PIT)是一种新兴的靶向肿瘤治疗方法,通过将单克隆抗体(monoclonal antibody,mAb)与光吸收剂IRDye700DX(IR700)偶联形成抗体-光吸收剂结合物(antibody-photoabsorber conjugate,APC)(
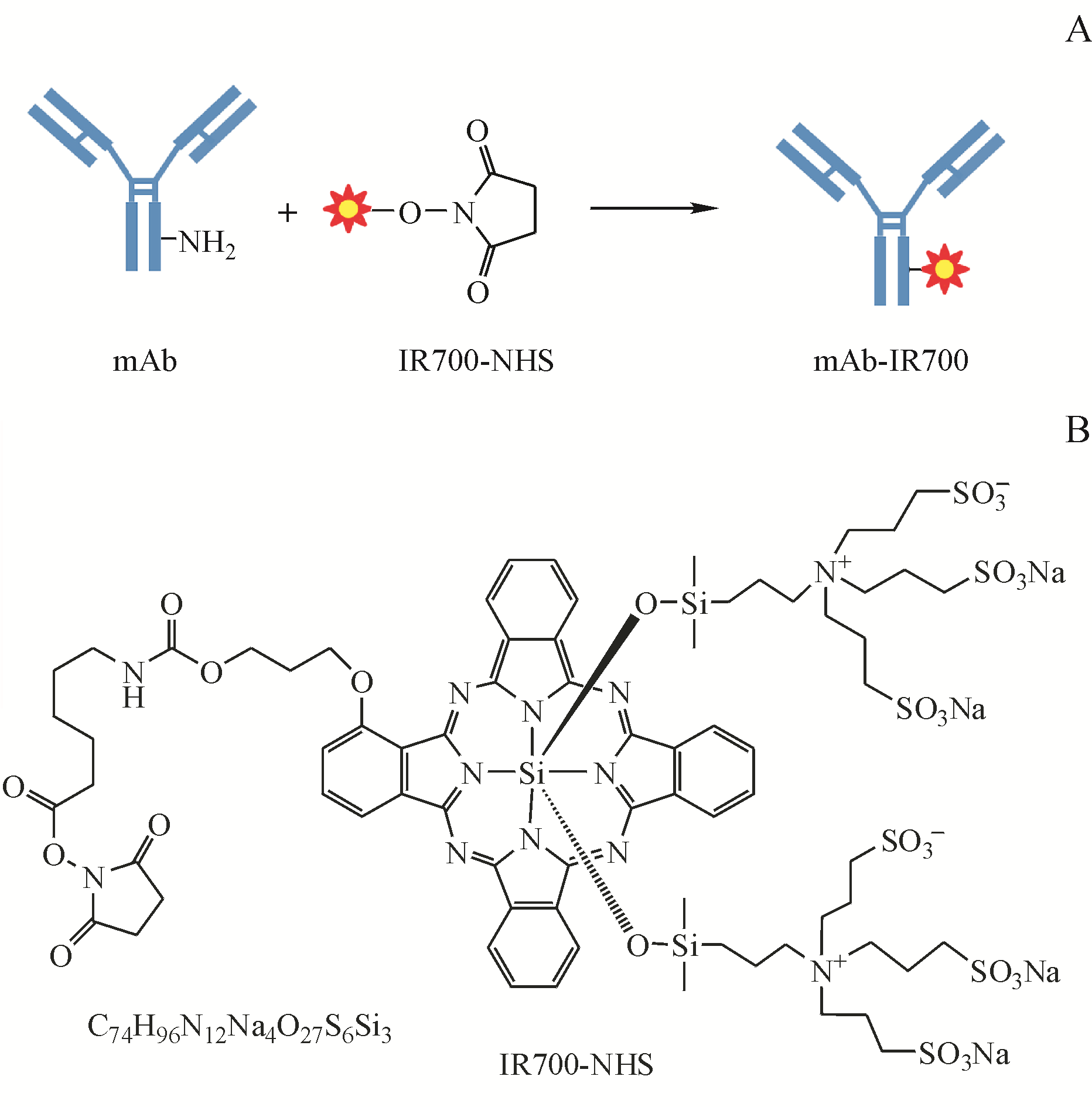
Figure 1 Components of Near infrared photoimmunotherapy (NIR-PIT)
A:Synthetic strategy of antibody-photoabsorber conjugate; B:Structure diagram of IR700-NHS
NIR-PIT需要mAb、光吸收剂与NIR光3个要素,是将抗体静脉注射的特异性与光吸收剂经NIR光照射后的急性毒性相结合的一种靶向光动力学疗法,也是近年肿瘤治疗研究中的热点之一。虽然大多数的APC还处于实验室或动物研究阶段,但前期的研究结果均证实了NIR-PIT能够高效杀灭靶肿瘤细胞,且不会破坏非靶肿瘤或正常组织。
在现有靶向治疗中,mAb治疗的历史最为悠久。截至2018年5月10日,FDA已批准80 个治疗性mAb,但其使用剂量较大,成本非常高。也有研究将低剂量的mAb用作传递放射性核素、化学药物或生物毒素等的载
目前,文献报道的抗体主要靶向EGF
虽然靶向光疗概念的提出已经有30 多年了,但是传统PDT中使用的光吸收剂仍大多为选择性差疏水性大的小分子。它们不仅能够与肿瘤细胞结合,也可以和包括皮肤、其他上皮表面在内的正常细胞结合而引起不必要的光毒性。尽管学者们尝试将多种常规光吸收剂与mAb相结合以改善其选择性,然而效果并不明显,尤其在其体内疗效评价上。
IR700是一种具有高消光系数和中荧光量子产率的硅酞菁染料,NIR光激发波长为690 nm。它对自然光具有光化学稳定性,即便在高染料/蛋白比时也不会聚集,且无非特异性的蛋白结
NIR光疗本身不是热疗或破坏性疗法,因此可以安全地输送到正常组织而没有毒性。波长在700 nm附近的NIR光在活组织内表现出较高的光学穿透力,因为在此波长下,内源性发色团(水、血红蛋白、胶原蛋白等)的吸收度极低。除了借助mAb的主动靶向性外,还可通过控制光照部位,选择性活化靶部位的APC而杀死肿瘤细胞。NIR-PIT使用的NIR光是非电离的,对DNA无损伤,能够穿透至组织内1 ~ 2 cm
研究表明,影响PIT抗肿瘤效果的因素涉及APC浓度、光剂量、光源的功率密度
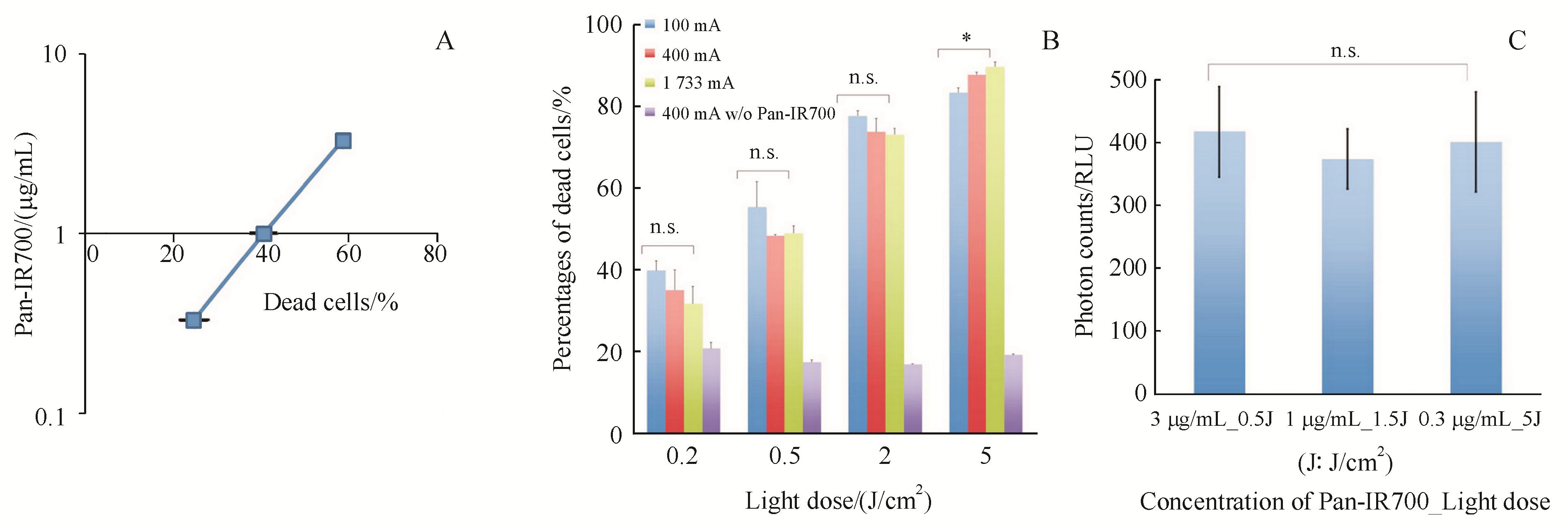
Figure 2 Phototoxicity of Pan-IR700 mediated PI
A:At a constant light dose of 2 J/c
另外,Peng
NIR-PIT的抗肿瘤作用机制与APC在靶细胞的分布密切相关,定位于线粒体或者细胞质的光吸收剂能够诱导细胞凋亡,而分布于细胞膜的光吸收剂会导致细胞坏
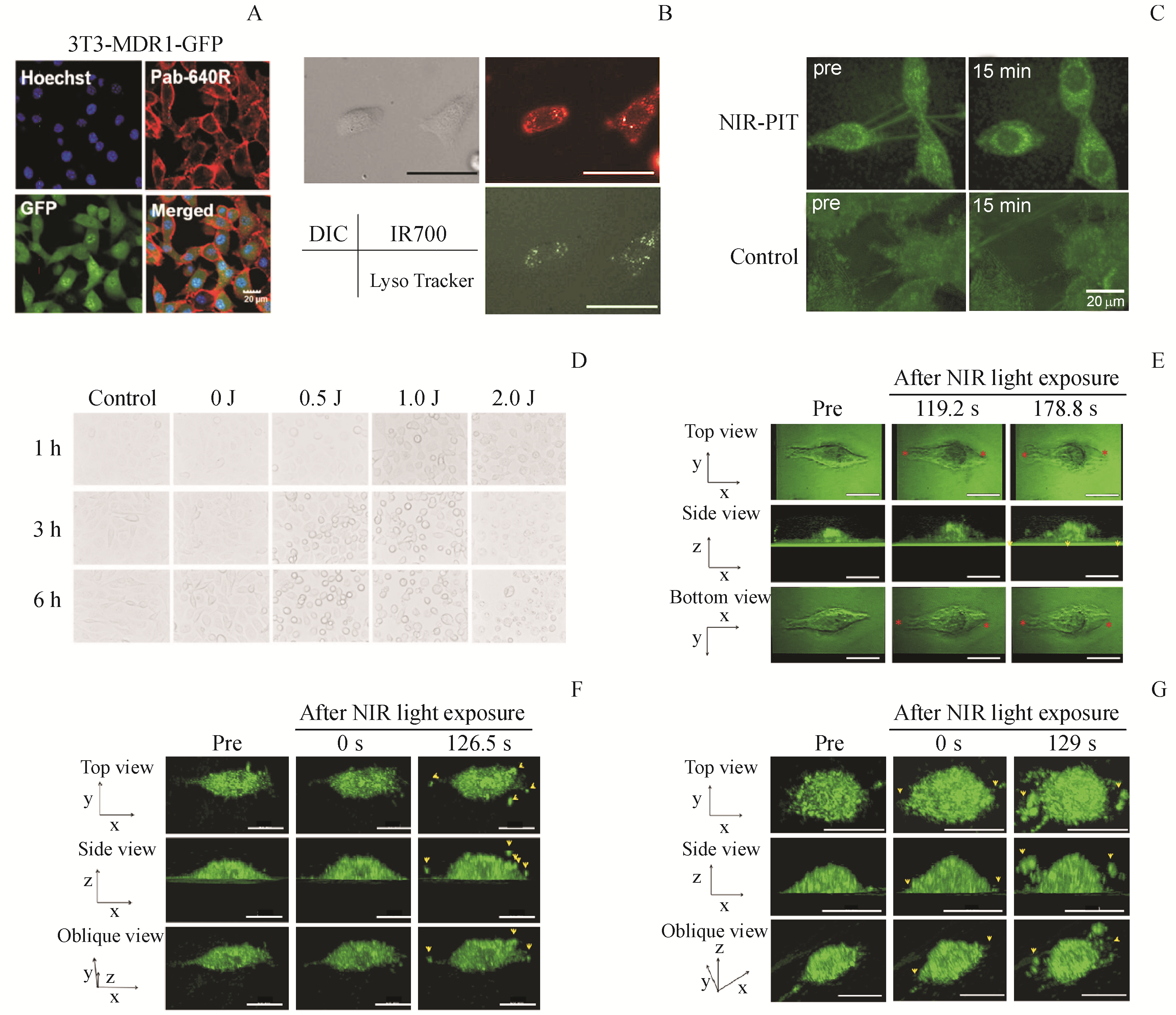
Figure 3 Cellular localization of APC and morphological changes of cell membrane after NIR-PIT
A:Confocal images of the distribution of Pab-640R in P-gp positive and GFP-expressing 3T3-MDR1 cells. Nucleus was stained by Hoechst 33342 (blue
丝状伪足是从细胞边缘伸出来的富含肌动蛋白的薄手指样突起,普遍存在于肿瘤细胞中,在肿瘤细胞转移及促进扩散癌细胞在次生器官的生存与增殖中发挥重要作用。以NIR光照射Tra-IR700处理的3T3/HER2细胞后15 min可观察到丝状伪足的数量明显减少(
在细胞膜由完整、损伤到破裂的过程中,其通透性也发生了明显的变化。在NIR光照射后立即就观察到高渗透压条件下N
Sato
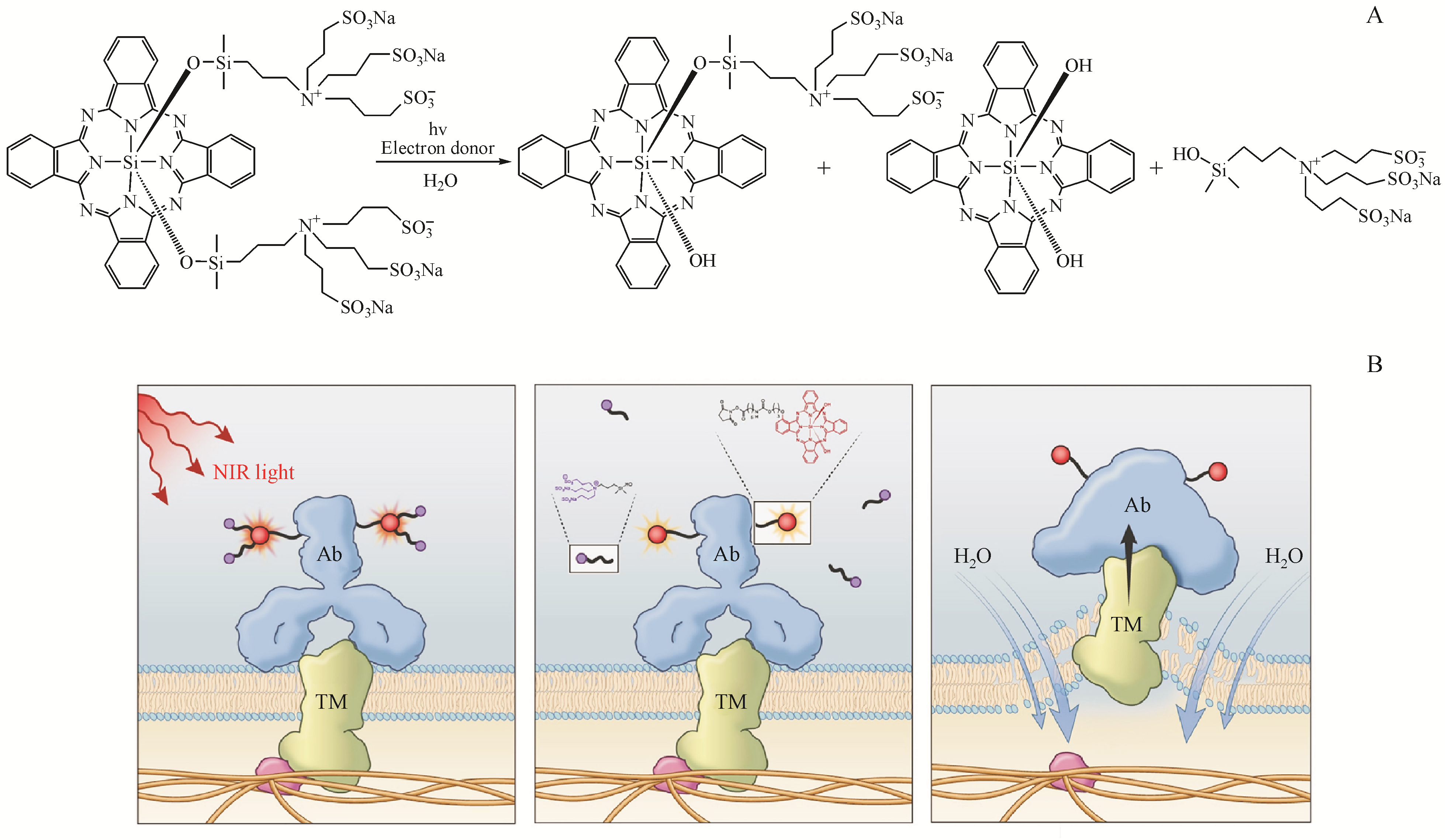
Figure 4 Mechanism of NIR-PIT mediated cytotoxicity
A:Scheme of chemistry basis for NIR-PIT;B:Schematic diagram for physical changes of APC-antigen complex
利用三维动态活细胞显微镜、放射性和荧光探针以及生物标记物进一步研究了NIR-PIT细胞毒作用的机
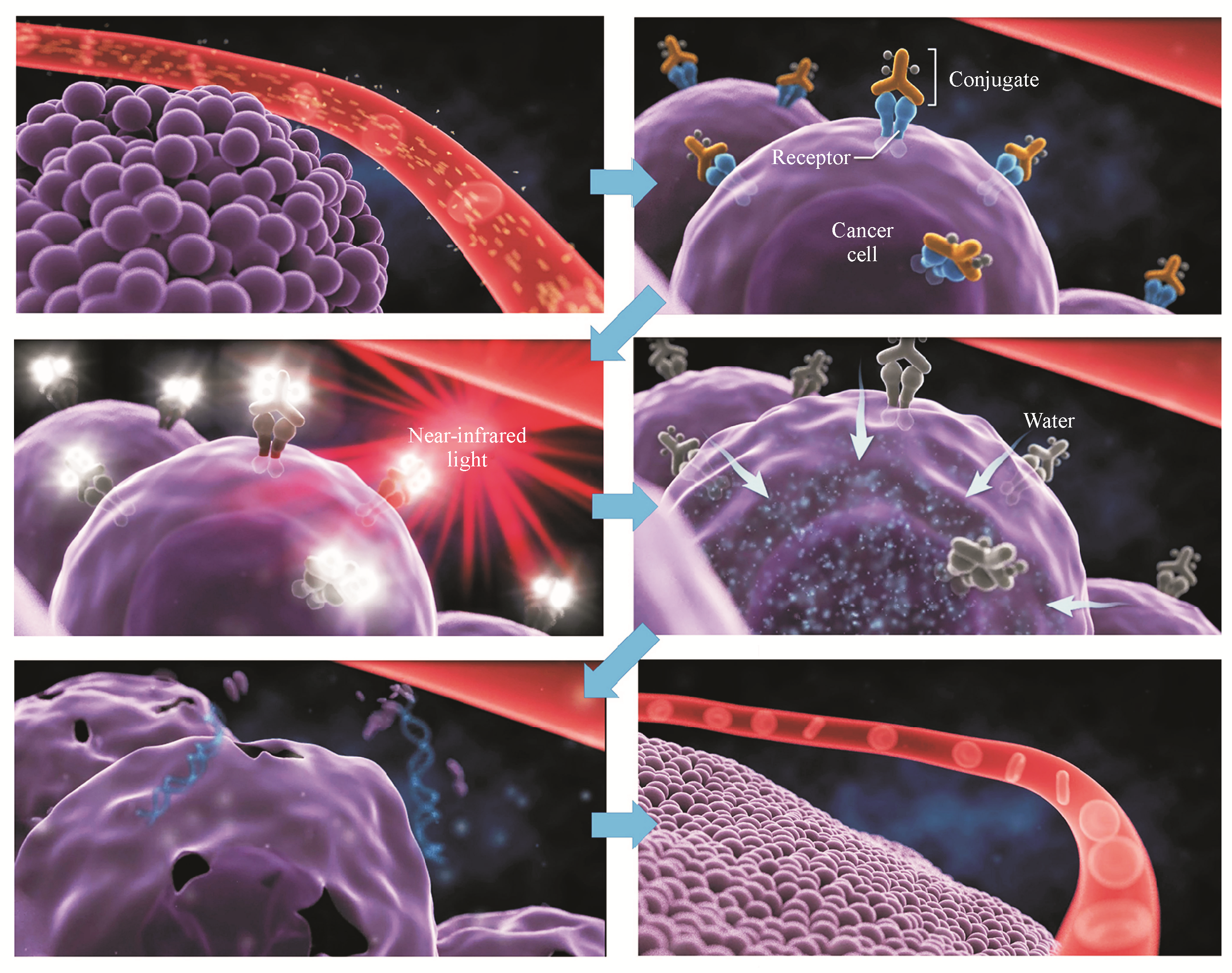
Figure 5 Schematic diagram of NIR-PIT induced cellular toxicity
除此之外,Mitsunaga
NIR-PIT使用LED灯和激光光源进行表面光照在动物模型上取得了良好的疗效。被FDA批准临床Ⅲ期试验的cetuximab-IR700也是通过静脉给药,并于约24 h后用激光光源以690 nm波长NIR光对肿瘤进行照射治疗,许多患者的肿瘤明显缩小,且副作用很小。NIR-PIT的疗效取决于APC进入靶组织的能力以及将NIR光传递到该组织的能力。NIR光可通过外部光源轻松地传递到口腔和皮肤的病变处,但是,在更深处的肿瘤中,由于组织中天然吸收剂的存在,光会迅速衰减,且单个光源的照射可能会产生异质性NIR光暴露,从而导致肿瘤的治疗不充分。
4.1.1 使用光纤扩散
4.1.2 内窥镜结合光纤扩散器
理论上,光可以传递到体腔(例如腹膜和胸腔)中并扩散,从而暴露出较大的表面积。但事实上,转化到人体时往往没有那么容易。将NIR光传送到诸如腹膜之类的体腔的一种解决方案就是使用针头或内窥镜将光纤与远端光学扩散器一起引

Figure 6 Multi-color fluorescence endoscopic system and NIR-PIT procedur
A:Multi-color fluorescence imaging system was composed of a clinically applicable fiber optic endoscope and light source; B:Cylindrical light diffuser with a NIR laser system; C:The endoscope was put into peritoneal cavity through a small incision,and the abdomen was inflated with air. Subsequently,abdominal cavity was exposed to NIR light by using the optical diffuser under endoscopic guidance
Maruoka
虽然光纤扩散器能够将光传递至体内几乎任何地方,但是,此过程具有侵入性,且不适合于NIR-PIT的重复曝光治疗。为了限制深层组织中重复治疗的侵入性,同时保证疗效,Nakajima
当NIR光被结合APC的组织吸收时,局部会产生一定的热量。在大多数情况下,这会导致亚临床皮肤温度升高。在暴露时间内若温度超过50 ℃,即可肉眼观察到皮肤的热损伤。在这种情况下,第2天就会出现可见的红斑迹象。但是,当皮肤温度保持在50 ℃以下时则观察不到这种损害。适当的NIR光剂量对实施NIR-PIT很重要,尽管它因肿瘤细胞类型、大小和光源等的不同而变化,但研究表明光剂量在10 ~ 100 J/c
Okuyama
表面皮肤温度的升高在很大程度上取决于总的光剂量。当光剂量恒定,激光引起的皮肤温度升高大于LED灯,这可能是激光的功率密度(600 mW/c
肿瘤大小变化是目前评价NIR-PIT体内抗肿瘤效果的常用指标,但是肿瘤的尺寸变化通常在治疗后3 ~ 4 d才能够显现出来。为此,实时监控PIT的治疗效果就显得非常重要,尤其是在内窥镜引导下手术和介入治疗过程中的即时反馈,因为只有如此才能确定一个PIT疗程是否有效、是否需要重复治疗以及是否需要更强的光照、额外的光剂量和/或APC的剂量等。虽然在体外观察到PIT可引起细胞形态的迅速变化,但遗憾的是目前临床上可用于实时评价PIT效果的成像技术还很有
根据Warburg效应,肿瘤生长需要过量的葡萄糖,因此,用于提供局部葡萄糖代谢指标
荧光蛋白(fluorescent protein,FP)是监测体内肿瘤生长的潜在替代方法。但是,不管细胞存活与否,FP都会保留其信号,甚至在坏死细胞中也可能被巨噬细胞吸收。因此,使用FP的荧光成像更适合于纵向监测光疗的效果。尽管IR700具有荧光且能反映肿瘤的负荷,但在溶酶体中分解代谢和光漂白后,荧光可能会减少,从而导致难以准确判断组织活力。所以,FP与IR700的荧光均不适合表征PIT的疗效。而FLT是一个可靠的评价指标,它不依赖于APC(如Pan-IR700)的浓度或溶液中的曝光量,似乎只有周围的化学微环境才会影响IR700的FLT。
IR700的FLT相对比较长,因此其FLT的变化可以是靶细胞死亡的很好的预测因子。随着Pan-IR700逐渐内化到溶酶体中,IR700的FLT逐渐变长且为孵育时间的函数(FLT从孵育1 h的2.98 ns延长至孵育24 h的3.42 ns)。当暴露于阈值及以上的NIR光时,Pan-IR700引起的细胞膜和溶酶体膜的破坏导致IR700在细胞质内聚集并进入细胞外空间,与此同时显著降低了IR700的FLT。因此,FLT的缩短可以作为PIT引起的急性膜损伤的指标。体内亦是如此,在单次有效剂量的NIR光照射后30 min内,可观察到体内治疗肿瘤的FLT缩短,它在肿瘤大小和形状改变前几天即显示出生物学效应。FLT能够立即读出肿瘤的状态,在治疗后可以立即评估PIT对肿瘤细胞的治疗效果,并帮助决定在治疗过程中是否需要额外的光剂
萤光素酶-萤光素光子计数技术是在报告基因技术的帮助下开发的,已广泛用于体内外分子和细胞生物学。萤光素酶-萤光素光子计数成像最常见的报告基因是编码萤火虫萤光素酶的基因,该酶通过消耗三磷酸腺苷(ATP)、M
NIR-PIT在体内外对正常细胞无毒,具有肿瘤细胞高度选择性,能够特异性地结合到肿瘤细胞表面,经NIR光照射引起细胞膜的破坏并诱导肿瘤细胞死亡。借助光纤扩散器、内窥镜、外部/间质光源联用等能将NIR光传递至肿瘤深处,从而改善NIR光的组织穿透性;借助风冷或降低功率密度延长照射时间可消除NIR-PIT对照射部位的热损伤;借助葡萄糖摄取、荧光寿命、生物发光信号等的变化可快速评价NIR-PIT的治疗效果。随着研究的逐渐深入,NIR-PIT有巨大的潜力成为临床应用广泛的肿瘤治疗手段。
参 考 文 献
Mitsunaga M,Ogawa M,Kosaka N,et al. Cancer cell-selective in vivo near infrared photoimmunotherapy targeting specific membrane molecules[J]. Nat Med,2011,17(12):1685‒1691. [百度学术]
Maruoka Y,Furusawa A,Okada R,et al. Combined CD44- and CD25-targeted near-infrared photoimmunotherapy selectively kills cancer and regulatory T cells in syngeneic mouse cancer models[J]. Cancer Immunol Res,2020,8(3):345‒355. [百度学术]
Sato K,Nagaya T,Mitsunaga M,et al. Near infrared photoimmunotherapy for lung metastases[J]. Cancer Lett,2015,365(1):112‒121. [百度学术]
Sato K,Nagaya T,Nakamura Y,et al. Near infrared photoimmunotherapy prevents lung cancer metastases in a murine model[J]. Oncotarget,2015,6(23):19747‒19758. [百度学术]
Kobayashi H,Choyke PL. Near-infrared photoimmunotherapy of cancer[J]. Acc Chem Res,2019,52(8):2332‒2339. [百度学术]
Zheng L,Tan W,Zhang J,et al. Combining trastuzumab and cetuximab combats trastuzumab-resistant gastric cancer by effective inhibition of EGFR/ErbB2 heterodimerization and signaling[J]. Cancer Immunol Immunother,2014,63(6):581‒586. [百度学术]
Boeckx C,Blockx L,de Beeck KO,et al. Establishment and characterization of cetuximab resistant head and neck squamous cell carcinoma cell lines:focus on the contribution of the AP-1 transcription factor[J]. Am J Cancer Res,2015,5(6):1921‒1938. [百度学术]
Sano K,Nakajima T,Choyke PL,et al. Markedly enhanced permeability and retention effects induced by photo-immunotherapy of tumors[J]. ACS Nano,2013,7(1):717‒724. [百度学术]
Burley TA,Maczynska J,Shah A,et al. Near-infrared photoimmunotherapy targeting EGFR-shedding new light on glioblastoma treatment[J]. Int J Cancer,2018,142(11):2363‒2374. [百度学术]
Nishimura T,Mitsunaga M,Sawada R,et al. Photoimmunotherapy targeting biliary-pancreatic cancer with humanized anti-TROP2 antibody[J]. Cancer Med,2019,8(18):7781‒7792. [百度学术]
Kiss B,van den Berg NS,Ertsey R,et al. CD47-targeted near-infrared photoimmunotherapy for human bladder cancer[J]. Clin Cancer Res,2019,25(12):3561‒3571. [百度学术]
Wei W,Jiang D,Ehlerding EB,et al. CD146-targeted multimodal image-guided photoimmunotherapy of melanoma[J]. Adv Sci (Weinh),2019,6(9):1801237. [百度学术]
Isobe Y,Sato K,Nishinaga Y,et al. Near infrared photoimmunotherapy targeting DLL3 for small cell lung cancer[J]. EBioMedicine,2020,52:102632. [百度学术]
Sato K,Hanaoka H,Watanabe R,et al. Near infrared photoimmunotherapy in the treatment of disseminated peritoneal ovarian cancer[J]. Mol Cancer Ther,2015,14(1):141‒150. [百度学术]
Nagaya T,Okuyama S,Ogata F,et al. Near infrared photoimmunotherapy using a fiber optic diffuser for treating peritoneal gastric cancer dissemination[J]. Gastric Cancer,2019,22(3):463‒472. [百度学术]
Nagaya T,Okuyama S,Ogata F,et al. Near infrared photoimmunotherapy targeting bladder cancer with a canine anti-epidermal growth factor receptor (EGFR) antibody[J]. Oncotarget,2018,9(27):19026‒19038. [百度学术]
Kobayashi H,Griffiths GL,Choyke PL. Near-infrared photoimmunotherapy:photoactivatable antibody-drug conjugates (ADCs) [J]. Bioconjug Chem,2020,31(1):28‒36. [百度学术]
Li F,Zhao Y,Mao C,et al. RGD-modified albumin nanoconjugates for targeted delivery of a porphyrin photosensitizer[J]. Mol Pharm,2017,14(8):2793‒2804. [百度学术]
Perez HL,Cardarelli PM,Deshpande S,et al. Antibody-drug conjugates:current status and future directions[J]. Drug Discov Today,2014,19(7):869‒881. [百度学术]
Amoury M,Bauerschlag D,Zeppernick F,et al. Photoimmunotheranostic agents for triple-negative breast cancer diagnosis and therapy that can be activated on demand[J]. Oncotarget,2016,7(34):54925‒54936. [百度学术]
Okuyama S,Nagaya T,Sato K,et al. Interstitial near-infrared photoimmunotherapy:effective treatment areas and light doses needed for use with fiber optic diffusers[J]. Oncotarget,2018,9(13):11159‒11169. [百度学术]
Nakajima T,Sato K,Hanaoka H,et al. The effects of conjugate and light dose on photo-immunotherapy induced cytotoxicity[J]. BMC Cancer,2014,14:389. [百度学术]
Sato K,Watanabe R,Hanaoka H,et al. Comparative effectiveness of light emitting diodes (LEDs) and lasers in near infrared photoimmunotherapy[J]. Oncotarget,2016,7(12):14324‒14335. [百度学术]
Peng W,de Bruijn HS,Farrell E,et al. Epidermal growth factor receptor (EGFR) density may not be the only determinant for the efficacy of EGFR-targeted photoimmunotherapy in human head and neck cancer cell lines[J]. Lasers Surg Med,2018,50(5):513‒522. [百度学术]
Nagaya T,Sato K,Harada T,et al. Near infrared photoimmunotherapy targeting EGFR positive triple negative breast cancer:optimizing the conjugate-light regimen[J]. PLoS One,2015,10(8):e0136829. [百度学术]
Kishimoto S,Bernardo M,Saito K,et al. Evaluation of oxygen dependence on in vitro and in vivo cytotoxicity of photoimmunotherapy using IR-700-antibody conjugates[J]. Free Radic Biol Med,2015,85:24‒32. [百度学术]
van Lith SAM,van den Brand D,Wallbrecher R,et al. The effect of subcellular localization on the efficiency of EGFR-targeted VHH photosensitizer conjugates[J]. Eur J Pharm Biopharm,2018,124:63‒72. [百度学术]
Mao C,Zhao Y,Li F,et al. P-glycoprotein targeted and near-infrared light-guided depletion of chemoresistant tumors[J]. J Control Release,2018,286:289‒300. [百度学术]
Nakamura Y,Nagaya T,Sato K,et al. Alterations of filopodia by near infrared photoimmunotherapy:evaluation with 3D low-coherent quantitative phase microscopy[J]. Biomed Opt Express,2016,7(7):2738‒2748. [百度学术]
Sano K,Mitsunaga M,Nakajima T,et al. Acute cytotoxic effects of photoimmunotherapy assessed by 18F-FDG PET[J]. J Nucl Med,2013,54(5):770‒775. [百度学术]
Ogata F,Nagaya T,Okuyama S,et al. Dynamic changes in the cell membrane on three dimensional low coherent quantitative phase microscopy (3D LC-QPM) after treatment with the near infrared photoimmunotherapy[J]. Oncotarget,2017,8(61):104295‒104302. [百度学术]
Nakajima K,Takakura H,Shimizu Y,et al. Changes in plasma membrane damage inducing cell death after treatment with near-infrared photoimmunotherapy[J]. Cancer Sci,2018,109(9):2889‒2896. [百度学术]
Sato K,Watanabe R,Hanaoka H,et al. Photoimmunotherapy:comparative effectiveness of two monoclonal antibodies targeting the epidermal growth factor receptor[J]. Mol Oncol,2014,8(3):620‒632. [百度学术]
Sato K,Choyke PL,Kobayashi H. Photoimmunotherapy of gastric cancer peritoneal carcinomatosis in a mouse model[J]. PLoS One,2014,9(11):e113276. [百度学术]
Kishimoto S,Oshima N,Yamamoto K,et al. Molecular imaging of tumor photoimmunotherapy:evidence of photosensitized tumor necrosis and hemodynamic changes[J]. Free Radic Biol Med,2018,116:1‒10. [百度学术]
Sato K,Ando K,Okuyama S,et al. Photoinduced ligand release from a silicon phthalocyanine dye conjugated with monoclonal antibodies:a mechanism of cancer cell cytotoxicity after near-infrared photoimmunotherapy[J]. ACS Cent Sci,2018,4(11):1559‒1569. [百度学术]
Dong H,Wu R,Liu J,et al. Advances in cancer photodynamic therapy[J]. J China Pharm Univ(中国药科大学学报),2016,47(4):377‒387. [百度学术]
Isoda Y,Piao W,Taguchi E,et al. Development and evaluation of a novel antibody-photon absorber conjugate reveals the possibility of photoimmunotherapy-induced vascular occlusion during treatment in vivo[J]. Oncotarget,2018,9(59):31422‒31431. [百度学术]
Nagaya T,Okuyama S,Ogata F,et al. Endoscopic near infrared photoimmunotherapy using a fiber optic diffuser for peritoneal dissemination of gastric cancer[J]. Cancer Sci,2018,109(6):1902‒1908. [百度学术]
Maruoka Y,Nagaya T,Sato K,et al. Near infrared photoimmunotherapy with combined exposure of external and interstitial light sources[J]. Mol Pharm,2018,15(9):3634‒3641. [百度学术]
Nakajima K,Kimura T,Takakura H,et al. Implantable wireless powered light emitting diode (LED) for near-infrared photoimmunotherapy:device development and experimental assessment in vitro and in vivo[J]. Oncotarget,2018,9(28):20048‒20057. [百度学术]
Mitsunaga M,Nakajima T,Sano K,et al. Near-infrared theranostic photoimmunotherapy (PIT):repeated exposure of light enhances the effect of immunoconjugate[J]. Bioconjug Chem,2012,23(3):604‒609. [百度学术]
Mitsunaga M,Nakajima T,Sano K,et al. Immediate in vivo target-specific cancer cell death after near infrared photoimmunotherapy[J]. BMC Cancer,2012,12:345. [百度学术]
Okuyama S,Nagaya T,Ogata F,et al. Avoiding thermal injury during near-infrared photoimmunotherapy (NIR-PIT):the importance of NIR light power density[J]. Oncotarget,2017,8(68):113194‒113201. [百度学术]
Nakajima T,Sano K,Mitsunaga M,et al. Real-time monitoring of in vivo acute necrotic cancer cell death induced by near infrared photoimmunotherapy using fluorescence lifetime imaging[J]. Cancer Res,2012,72(18):4622‒4628. [百度学术]
Maruoka Y,Nagaya T,Nakamura Y,et al. Evaluation of early therapeutic effects after near-infrared photoimmunotherapy (NIR-PIT) using luciferase-luciferin photon-counting and fluorescence imaging[J]. Mol Pharm,2017,14(12):4628‒4635. [百度学术]